Оксид азота (v)
Содержание:
- Общие сведения:
- Описание одновалентного оксида азота
- Практика применения
- Физические свойства:
- Формула азота в химии
- Страницы
- Электронное строение азота
- Мощные донаторы азота
- Практическое применение
- Оксид азота (I, II, III, IV, V): свойства, получение, применение
- Важнейшие соединения азота
- Несолеобразующие соединения
- Виды и свойства
- Влияние на живые организмы
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Оксид азота (V) |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | N2O5 |
| 106 | Тип | Неорганическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3NH4).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.
Практика применения
Думаю, что многих заинтересует именно практическая сторона вопроса. Как закидывать? Сколько шарашить? И другие важные вопросы.
- Принимайте NO на голодный желудок.
- Если ваш вес более 100 кг, то можно сразу начать с удвоенной дозировки (в среднем 2 черпака).
- Через две недели можно увеличивать дозировку вдвое (для всех).
- Общая продолжительность применения NO в среднем не должна превышать одного месяца.
Ощущения от применения
- Мышечную массу на самом деле они не увеличили, а вот рост силы был довольно заметен.
- Дикое повышение выносливости, настроения, двигательной активности.
- Метаболизм в мышцах вырос. Это я отметил из-за улучшенного процесса сжигания жира.
- Излишняя возбудимость. Я тренируюсь в вечернее время, и при увеличении дозировки иногда бывает сложно уснуть ночью.
- Улучшенная эрекция >:D Приятный бонус, безусловно. Кстати, у женщин так же наблюдается улучшенное кровенаполнение половых органов.
- Более сбалансированное питание. Т.к. сложно получить все необходимые нутриенты в нужных пропорциях из обычной пищи.
Так же есть и такие моменты, которые часто заявлены производителями, но я ИХ НЕ ОЩУТИЛ:
- Повышенного «зарастания» повреждённых тканей не было! Всё заживает как обычно.
- Никакие, на фиг, шлаки не выводятся. Об этом частенько пишут производители, но ребят, уверяю вас, что в медицине ВООБЩЕ НЕТ такого термина, как шлаки! Это просто очередной шарлатанский трюк.
Так же есть те, кому эту добавку я бы НЕ СОВЕТОВАЛ применять вообще:
- Не применять детям. Иногда на банке с надписью «NO» можно увидеть, что для роста детям помогает данная добавка. Друзья, дети и так растут на глазах и если помогать их росту, то уж точно не оксидом азота.
- Не применять людям с вегетососудистой дистонией. Приводить в норму кровяное давление нужно специальными лекарственными препаратами, а не донаторами азота.
Что использовал
Мне удалось попробовать несколько довольно не плохих предтренировочных комплексов, способствующих выработке NO.
Nitrix 2.0 от BSN — этот прекурсор мне понравился! Ощущения крайне необычные. Есть покалывания под кожей приятные, активность увеличивается, отличный памп. Покупал по этой ссылке в магазине.
NO Explode от BSN – не плохая штука. Однозначно становишься активнее, наблюдается увеличение силы, выносливости, не плохой пампинг (кровенаполнение). Всё это скорее результат действия кофеина, таурина и растительного экстракта барвинка малого. С огромной скидкой можете купить в этом магазине.
Niox от Nutrex Research Labs – ощущал сильный всплеск энергии, приятные покалывания кожи, становится тепло (прилив тепла) всем конечностям, хорошо наполняет мышцы кровью. Во время применения были тренировки, когда попросту «не мог устать» и заставлял себя уходить из зала. Хорошая штука, мне понравилась. Дешевле всего сейчас можно купить .
SuperPump MAX от Gaspari – весь кайф от азотной накачки наблюдается, так же прилив силушки богатырской, активность и полёт нормальные. Купить можно тут.
Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Формула азота в химии
Атомная масса: 14,008.а.е.м.
Электронная и графическая формула азота
Электронная формула: 1s
2 2s2 2p3.
Электронно-графическая формула внешнего электронного слоя атома азота:
Азот является одним из самых распространенных элементов на Земле, а также одним из основных биогенных элементов, входит в состав белков и нуклеиновых кислот.
Азот – простое вещество, состоящее из двух атомов азота.
Формула: N2.
Структурная формула азота
Структурная формула:
Молярная масса: 28,016 г/моль.
При нормальных условиях азот – бесцветный газ, не имеет запаха, цвета и вкуса, плохо растворим в воде. В жидком состоянии – бесцветная, подвижная жидкость.
При контакте с воздухом жидкий азот поглощает из него кислород. В твердом состоянии (−209,86°C) существует в виде снегоподобной массы или больших белоснежных кристаллов.
Молекула азота очень прочная, поскольку между атомами азота в молекуле N2 образуется тройная связь N≡N. Вследствие этого многие соединения азота имеют положительную энтальпию образования (галогениды, азиды, оксиды), а соединения азота термически неустойчивы и довольно легко разлагают ся при нагревании. Химически азот довольно инертен, поэтому в природе находится главным образом в свободном состоянии.
Азот при обычных условиях реагирует только с литием:
при нагревании может вступить в реакцию с некоторыми другими металлами и неметаллами, также с образованием нитридов:
Наибольшее практическое значение имеет аммиак (нитрид водорода) NH3, который получается при взаимодействии водорода с азотом:
В электрическом разряде азот реагирует с кислородом, образуя оксид азота(II) NO:
Азот также может образовывать комплексные соединения с переходными металлами.
Страницы
Главная страницаОСНОВЫ ОБЩЕЙ ХИМИИ1.1 Важнейшие классы неорганических веществ2.1 Вещества. Атомы2.2 Размеры атомов2.3 Молекулы. Химические формулы2.4 Простые и сложные вещества2.5 Валентность элементов2.6 Моль. Молярная масса2.7 Закон Авогадро2.8 Закон сохранения массы веществ2.9 Вывод химических формул3.1 Строение атома. Химическая связь3.2 Строение атома3.4 Строение электронной оболочки атома3.5 Периодическая система химических элементов3.6 Зависимость свойств элементов3.7 Химическая связь и строение вещества3.8 Гибридизация орбиталей3.9 Донорно-акцепторный механизм образования3.10 Степени окисления элементов4.1 Классификация химических реакций4.2 Тепловые эффекты реакций4.3 Скорость химических реакций4.4 Необратимые и обратимые реакции4.5 Общая классификация химических реакцийНЕОРГАНИЧЕСКАЯ ХИМИЯ5.1 Растворы. Электролитическая диссоциация5.2 Количественная характеристика состава растворов5.3 Электролитическая диссоциация5.4 Диссоциация кислот, оснований и солей5.5 Диссоциация воды5.6 Реакции обмена в водных растворах электролитов5.7 Гидролиз солей6.1 Важнейшие классы неорганических веществ6.2 Кислоты, их свойства и получение6.3 Амфотерные гидроксиды6.4 Соли, их свойства и получение6.5 Генетическая связь между важнейшими классами6.6 Понятие о двойных солях7.1 Металлы и их соединения7.2 Электролиз7.3 Общая характеристика металлов7.4 Металлы главных подгрупп I и II групп7.5 Алюминий7.6 Железо7.7 Хром7.8 Важнейшие соединения марганца и меди8.1 Неметаллы и их неорганические соединения8.2 Водород, его получение8.3 Галогены. Хлор8.4 Халькогены. Кислород8.5 Сера и ее важнейшие соединения8.6 Азот. Аммиак. Соли аммония8.7 Оксиды азота. Азотная кислота8.8 Фосфор и его соединения8.9 Углерод и его важнейшие соединения8.10 Кремний и его важнейшие соединенияОРГАНИЧЕСКАЯ ХИМИЯ9.1 Основные положения органической химии. Углеводороды9.2 Электронные эффекты заместителей в органических соединениях9.3 Предельные углеводороды (алканы)9.3.1 Насыщенные УВ. Метан9.4 Понятие о циклоалканах9.5 Непредельные углеводороды9.6 Диеновые углеводороды (алкадиены)9.7 Алкины9.8 Ароматические углеводороды9.9 Природные источники углеводородов10.1 Кислородсодержащие органические соединения10.2 Фенолы10.3 Альдегиды10.4 Карбоновые кислоты10.5 Сложные эфиры. Жиры10.6 Понятие о поверхностно-активных веществах10.7 Углеводы11.1 Амины. Аминокислоты11.2 Белки11.3 Понятие о гетероциклических соединениях11.4 Нуклеиновые кислоты12.1 Высокомолекулярные соединения12.2 Синтетические волокна▼
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — 2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
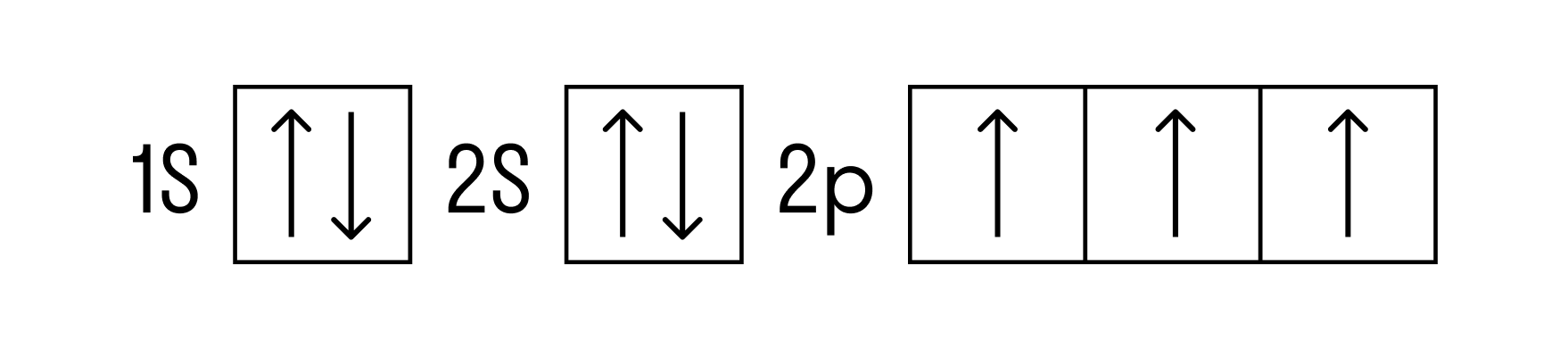
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получить

Мощные донаторы азота
Нужно сказать, что на данный момент во всех спортивных добавках и на всех цветастых баночках спортивного питания, где вы найдёте заветные буквы «NO» используются малоэффективные компоненты.
Решение нужно искать в медицине, где давно уже используются препараты, которые по сравнению с аргинином гораздо сильнее способствуют выработке оксида азота в крови.
Эти препараты относятся к классу НИТРАТЫ и самые известные из них:
- Изосорбид (нитросорбид).
- Нитроглицерин;
Изосорбид или, если быть точным, ИЗОСОРБИДА ДИНИТРАТ имеет более длительный период действия, однако дозировка должна быть снижена как минимум в 1,5-2 раза из-за того, что при употреблении рекомендованной терапевтической дозировки могут быть побочные эффекты: учащённое сердцебиение, головная боль, артериальная гипотензия (снижение артериального давления), пульсация сосудов и т.д. Правда переживать не стоит. Все эти побочные эффекты связаны с увеличением концентрации оксида азота в крови, поэтому стоит просто уменьшить дозировку.
Практическое применение
Химические свойства оксида азота нашли практическое применение. Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:
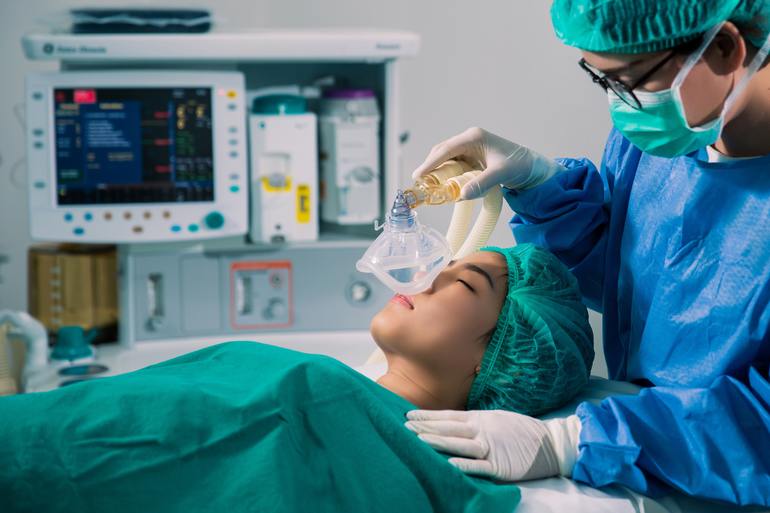
- Влияние оксида азота на организм человека используется в медицинской практике. В хирургии применяется для дачи ингаляционного наркоза в смеси с кислородом (2 части кислорода на 8 частей закиси азота).
- Поскольку NO2 обладает свойствами сильного окислителя, он используется в производстве ракетного топлива. Когда вещество взаимодействует с гидразином, образуется колоссальное количество энергии. Кроме того, оно используется для изготовления взрывчатых смесей.
- Соединение NO2 применяется в химии для производства серной и азотной кислоты.
- С помощью NO улучшают технические качества двигателей внутреннего сгорания у автомобилей.
- В пищевой промышленности вещество применяется в качестве добавки для улучшения вкуса готовых продуктов. На упаковках ему соответствует символ Е942.
- Монооксид и оксид трёхвалентного азота используется в химической промышленности в качестве сырья для производства азотной кислоты и её солей.
Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
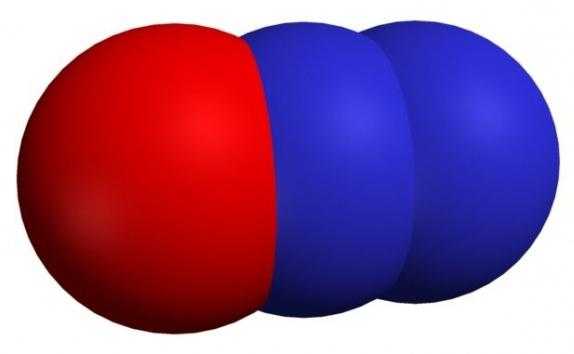
Оксид азота (I)
 2
2
Свойства
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Получение
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Применение
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)

Свойства
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Получение
Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Применение
Это одно из веществ, из которых получают азотную кислоту.
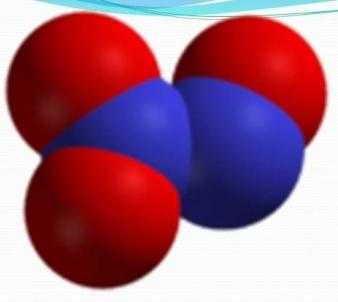
Оксид азота (III)
 23
23
Свойства
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Получение
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
Применение
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
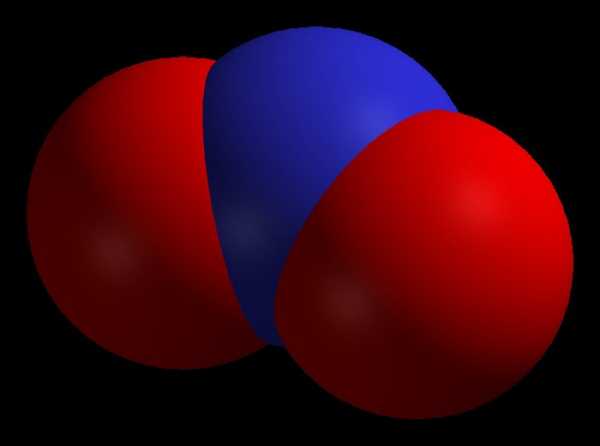
Оксид азота (IV)
 2
2
Свойства
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Получение
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
25
Свойства
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС.
Получение
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Применение
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина
Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
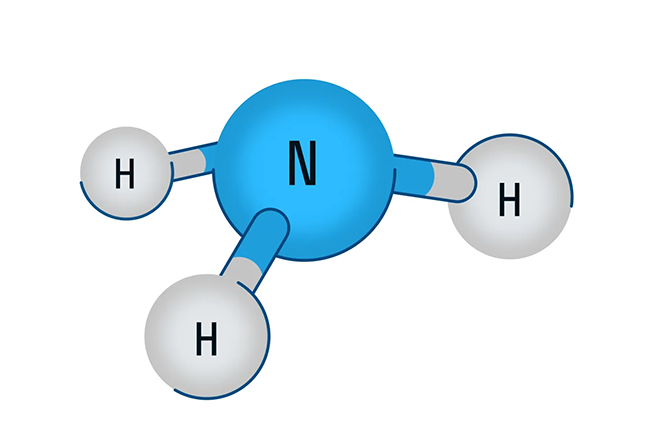
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
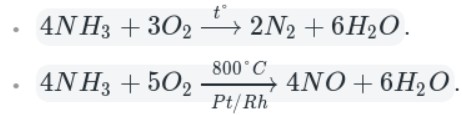
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
-
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
-
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
-
NH3 + HCl = NH4Cl
-
NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
-
Промышленный способ — синтез из простых веществ:
-
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
-
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O -
Окисление оксида азота (II)
2NO + O2 = 2NO2 -
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
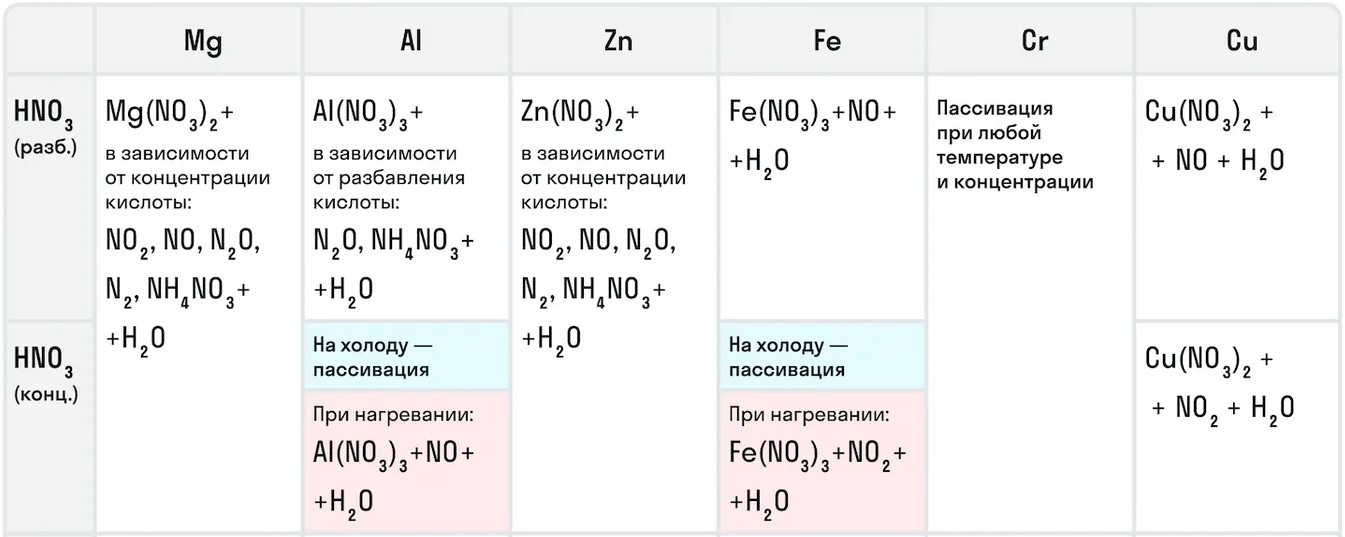
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
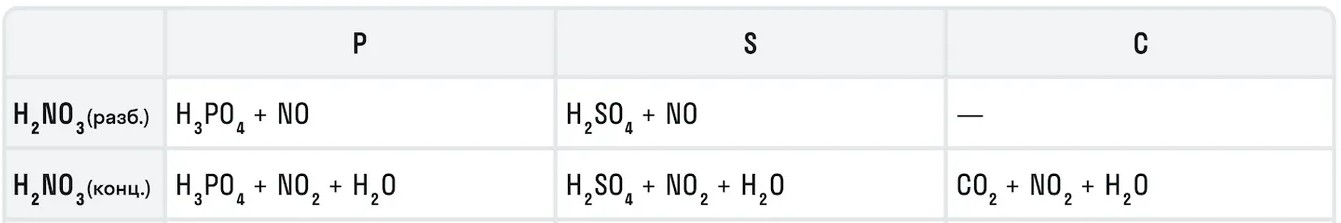
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
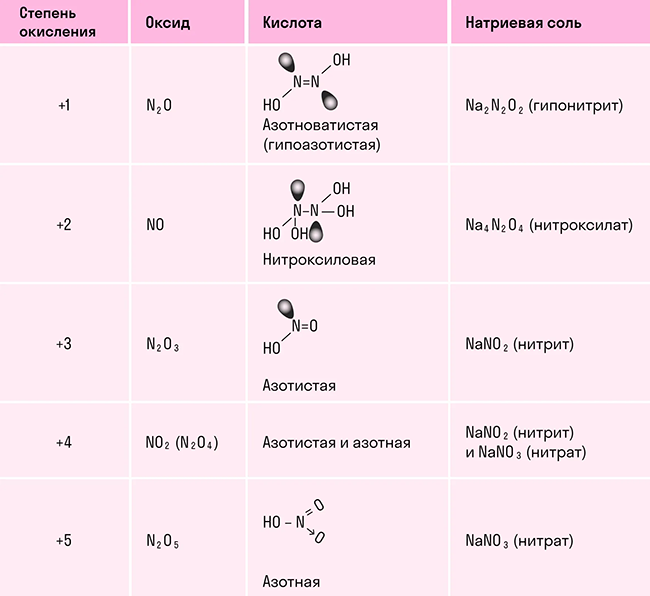
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.

Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Виды и свойства
Азот — вещество, которое образует несколько групп оксидов. Все они обладают разной молярной массой и физическими характеристиками. В группу солеобразующих входят:

Триоксид диазота (III). Химическая формула N2O3, кратность связи равна 3. Вещество имеет вид жидкости тёмно-синего цвета, плотность которой меньше плотности воды. Кристаллизуется при температуре -100 градусов. Этот кислотный оксид реагирует со щелочами, образуя соли. С водой образует азотистую кислоту: N2O3+H2O = 2HNO2.
Двуокись азота (IV) — NO2. Атомы в молекуле расположены под углом к друг другу. Вещество является ядовитым газом бурого цвета, имеет характерный запах. Легко растворимо в воде. Оксид образует 2 кислоты — азотную и азотистую. Азотная кислота образуется в присутствии воздуха и воды. Со щелочами образует 2 соли — нитрат и нитрит. При температуре меньше 22 градусов молекулы димеризуются и образуется N2O4. Образуется жидкость, которая при дальнейшем охлаждении превращается в кристаллы.
Пентаоксид (V) — N2O5. Другое название — азотный ангидрид. Представляет собой кристаллы, имеющие белую окраску. При нормальной температуре и давлении легко разлагается. При низких температурах сохраняет высокую степень устойчивости. Обладает свойствами окислителя и восстановителя.
Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор. Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.