Веселящий газ: безобидный наркоз или опасный наркотик?
Содержание:
- Виды оксидов
- Получение оксидов
- Последствия злоупотребления веселящего газа
- Свойства молекулярного азота
- Что такое оксид азота
- Побочные эффекты оксида азота
- Страницы
- Какой может быть вред от закиси азота
- Номенклатура оксидов
- Общее описание
- Начнем с определения
- Влияние веселящего газа на организм
- Важнейшие соединения азота
- Химические свойства азота
- Признаки употребления
- Принцип работы закиси азота
- ИТОГ
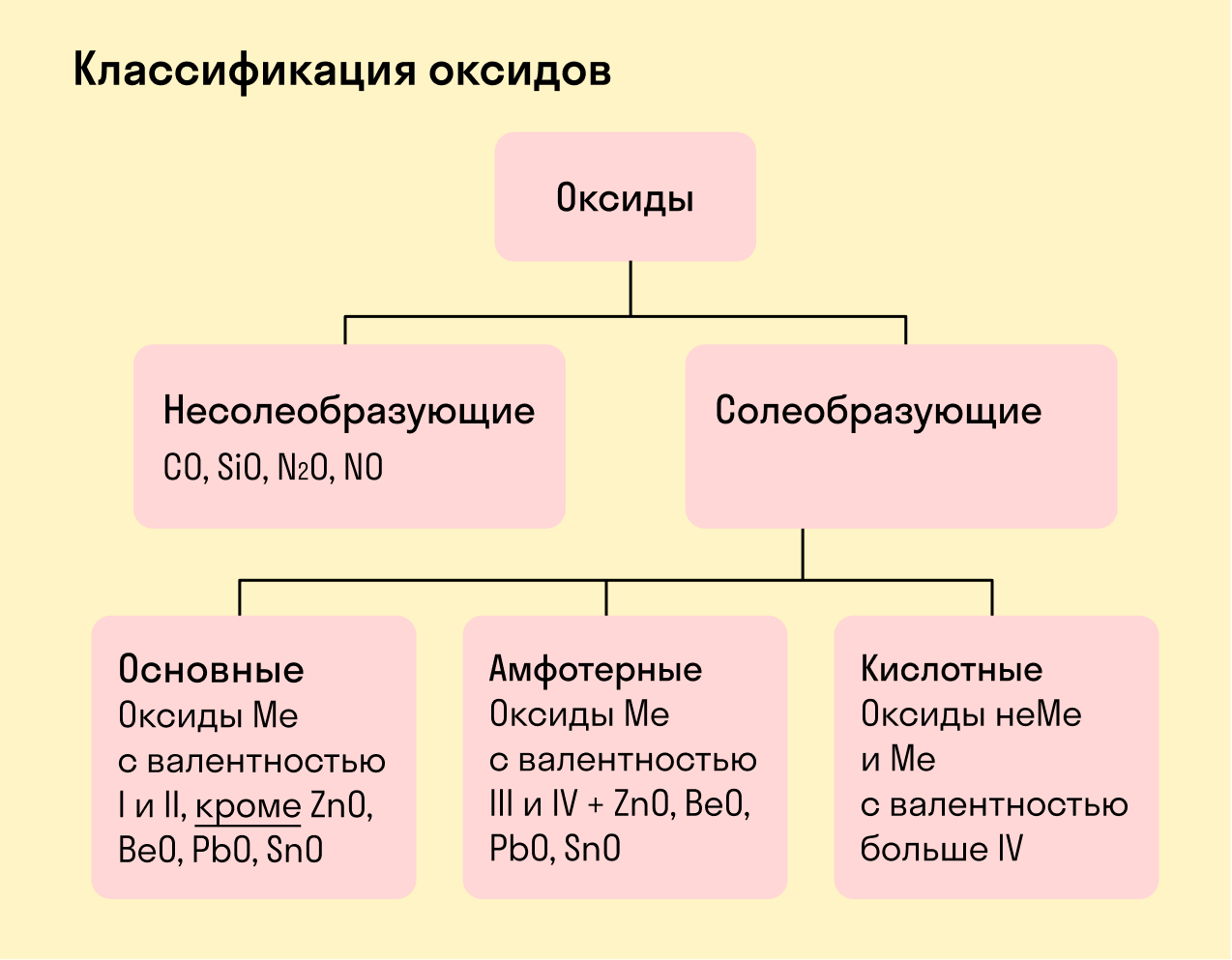
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
-
CrO (оксид хрома (II)) — проявляет основные свойства;
-
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
-
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
Ag(OH) = Ag2O + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
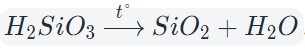
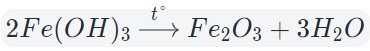
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Последствия злоупотребления веселящего газа
Даже небольшая доза вещества способна спровоцировать развитие психических заболеваний, проблемы с сердечно-сосудистой системой, бесплодие. Находясь под действием закиси азота, человек подвергает свое здоровье серьезным рискам.
- Происходит сильнейшая интоксикация организма;
- На клеточном уровне вредное влияние проявляется в анемии крови;
- Дефицит кислорода вызывает гипоксию;
- Действие закиси азота проявляется в нарушении координации движений;
- Вследствие угнетения дыхания может возникнуть асфиксия;
- Если немедицинскую закись азота употребляет беременная женщина, это может спровоцировать уродство плода
- При систематическом употреблении закиси азота в неразбавленном виде формируется психологическая зависимость.
На данный момент вещество не относится к запрещенным и остается в свободной продаже. Его низкая стоимость по сравнению с другими психоактивными веществами делает его чрезвычайно привлекательным для желающих получить опьянение.

Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
Азот:
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием: 6Li + N2 = 2Li3N;
- при нагревании азот реагирует с металлами: 2Al + N2 = 2AlN;
- при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом: N2 + 3H2 2NH3;
- при температуре 1000°C азот реагирует с кислородом, бором, кремнием: N2 + O2 2NO.
- азот взаимодействует, как восстановитель:
- с кислородом: N2+O2 2N+2O-2 (оксид азота II)
- с фтором: N2+3F2 = 2N+3F3-1 (фторид азота III)
Что такое оксид азота
Оксид азота представляет собой оксид азота, имеющий химическую формулу NO. Здесь один атом азота связан с атомом кислорода посредством ковалентной связи. Это означает, что атом азота и атом кислорода делят свои неспаренные электроны. При комнатной температуре и давлении оксид азота является токсичным бесцветным газом.
Рисунок 1: Структура точки Льюиса для оксида азота
Молярная масса этого соединения составляет 30 г / моль. Температура плавления оксида азота составляет -164 ° С, а температура кипения составляет -152 ° С. Молекула оксида азота имеет линейную форму, потому что только два атома связаны друг с другом. Когда неспаренные электроны азота и кислорода делятся, на атоме азота появляется еще один неспаренный электрон. Но на атоме кислорода нет других неспаренных электронов, которыми можно поделиться. Тогда неспаренный электрон делится один на два атома. Следовательно, фактическая структура ковалентной связи находится между двойной связью и тройной связью. Тогда длина связи составляет 115 мкм, что является меньшим расстоянием между двумя атомами, чем ожидаемое значение.
Рисунок 2: Фактическая связь между азотом и кислородом в оксиде азота
Оксид азота может образовывать диоксид азота в присутствии кислорода. Но в воде оксид азота реагирует с кислородом и Н2O с образованием азотистой кислоты (HNO2). Когда этот газ охлаждается, он образует димеры оксида азота (N2О2). Это некоторые основные реакции оксида азота.
Степень окисления азота в оксиде азота составляет +2. Это связано с тем, что степень окисления кислорода равна -2, а поскольку молекула закиси азота является нейтральным соединением, степень окисления азота должна составлять +2.
Побочные эффекты оксида азота
В окружающей среде оксид азота создаются естественным путем в результате таких явлений, как лесные пожары, молнии и выбросы в почву. Искусственные источники включают двигатели внутреннего сгорания, электростанции, удобрения и сельскохозяйственное сжигание.
Может ли слишком много окиси азота быть вредным?
Да, NO является токсичным газом в высоких концентрациях.
Вдыхание оксида азота может быть опасным. Иногда он используется для новорожденных, у которых есть дыхательная недостаточность из-за легочной гипертонии. Побочные эффекты при вдыхании оксида азота могут включать помутнение зрения, спутанность сознания, головокружение и потоотделение. Более серьезные побочные эффекты могут включать учащенное сердцебиение и голубоватые губы, ногти или ладони.
Побочные эффекты добавок оксида азота различаются в зависимости от того, какой препарат оксида азота вы выберете:
- Побочные эффекты и взаимодействия с добавкой свеклы включают иногда выделение мочи или испражнений розового или красного цвета. Иногда розовая моча после употребления свекольного сока также может косвенно свидетельствовать о синдроме «дырявого» кишечника.
- Побочные эффекты и взаимодействия с добавками L-аргинина включают боль в животе, вздутие живота, диарею, подагру, аномалии крови, аллергии, воспаление дыхательных путей, ухудшение астмы и низкое кровяное давление.
- Побочные эффекты и взаимодействия L-цитруллина включают потенциально опасное падение артериального давления, наряду с другими лекарственными взаимодействиями.
Меры предосторожности
Согласно статье, опубликованной в 2016 году в журнале Nitric Oxide, в настоящее время нет общедоступного и надежного теста, доступного для определения уровня NO в организме. В настоящее время на рынке есть тест-полоски из оксида азота слюны, но «они вряд ли точно оценят биодоступность оксида азота», говорится в документе. Поэтому единственным методом примерной оценки уровня оксида азота в организме является анализ симптоматики и вашего самочувствия.
Проконсультируйтесь с вашим лечащим врачом, прежде чем принимать препараты для оксида азота, особенно если вы в настоящее время беременны, кормите грудью, лечитесь от какого-либо заболевания или принимаете другие лекарства и / или добавки.
Заключительные мысли
- Итак, окись или оксид азота — полезен или вреден для здоровья? Подобно другим ключевым соединениям, содержащимся в организме человека, в оптимальных количествах он может способствовать укреплению здоровья различными способами.
- Оксид азота наиболее легко и безопасно можно увеличить с помощью пищевых источников.
- Продукты с высоким содержанием оксида азота — это продукты с высоким содержанием нитратов, которые повышают выработку NO. Эти продукты включают свеклу, листовую зелень, такую как руккола, эндивий, лук-порей, петрушка, брокколи и фенхель.
- Препараты оксида азота на самом деле не содержат оксида азота, но они содержат ингредиенты, которые являются известными усилителями оксида азота.
- Одной из лучших добавок NO может быть свекольный сок, порошок или капсулы, поскольку свекла известна своим высоким содержанием нитратов.
- Две аминокислоты, L-аргинин и L-цитруллин, также повышают выработку оксида азота в организме. Они также доступны в форме добавок для увеличения NO.
- Регулярные занятия спортом также помогают увеличить выработку NO в организме.
- Использование оксида азота включает снижение высокого кровяного давления, укрепление мозга и иммунитета, повышение производительности тренировки и улучшение ЭД / сексуального возбуждения.
Вам также будет интересно:
Спирулина – побочные эффекты и противопоказания
Как похудеть при поликистозе
Манжетка: лечебные свойства и противопоказания для женского здоровья
Влияние роста на здоровье
Функции простагландинов – виновников воспаления, и как их контролировать
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Какой может быть вред от закиси азота
1) Как мы уже с вами выяснили это запас прочности. Обычные двигателя навряд ли выдержат ее применение, потому как она загонит его в красную зону, а тут как говорится – рядом поломка.
2) Обязательно нужно улучшать кривошипно — шатунный механизм, обычный может не выдержать нагрузки.
3) Нужно переделывать систему подачи топлива, а также выхода отработанных газов, зачастую приходится жертвовать катализатором.
4) В некоторых случаях, приходится тюнинговать трансмиссию. Устанавливаются другие шестерни и т.д.
5) При некоторых типах закиси азота, требуется перепрошивка ЭБУ.
6) Катализатор – если настроить все правильно, он может не страдать, но как показывает практика, при настройке он все же может оплавиться. Так что нужно аккуратнее.
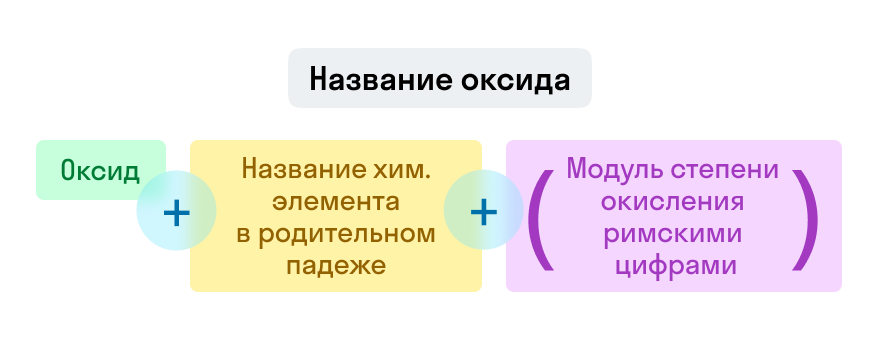
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
-
Fe2O3 — оксид железа (III). Читается: феррум два о три.
-
Na2O — оксид натрия. Читается: натрия два о.
-
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Общее описание
Азот – это бесцветный двухатомный газ (N2). Атомы в молекуле азота удерживает прочная тройная связь, что обуславливает инертность элемента. Азот реагирует с другими элементами и соединениями под действием внешних факторов – высокой температуры, электричества, катализаторов.
Рис. 1. Строение молекулы азота.
Оксиды образуются из солей аммония и азотной кислоты. Формулы оксидов азота и краткая характеристика соединений приведены в таблице.
|
Название |
Формула |
Получение |
Особенности |
|
Оксид диазота или оксид азота (I) – «веселящий газ» |
N2O |
– Нагревание нитрата аммония (опасность взрыва): NH4NO3 → N2O + 2H2O; – нагревание аминосульфоновой кислоты с разбавленной азотной кислотой: NH2SO2OH + HNO3 → N2O + H2SO4 + H2O |
Бесцветный газ со сладковатым привкусом. Не горит, токсичен. Растворим в воде, серной кислота, спирте |
|
Монооксид или оксид азота (II) |
NO |
Единственный оксид, получаемый непосредственным взаимодействием кислорода и азота при температуре 1200°С или при электрических разрядах: N2 + O2 → 2NO |
Бесцветный ядовитый газ. На воздухе окисляется, приобретая коричневый цвет. Трудно сжижается. В жидком виде имеет голубой цвет |
|
Триоксид диазота или оксид азота (III) |
N2O3 |
При взаимодействии разбавленной азотной кислоты и твёрдого оксида мышьяка с последующим охлаждением: – 2HNO3 + As2O3 → NO2 + NO + 2HAsO3; – NO2 + NO → N2O3 |
При нормальных условиях – синяя жидкость. Может приобретать газообразное и твёрдое состояния. Сильно токсичен, вызывает ожоги кожи |
|
Диоксид или оксид азота (IV) |
NO2 |
– При взаимодействии азотной кислоты и меди: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O; – при разложении нитрата свинца: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 |
Ядовитый газ бурого цвета с острым запахом. Легко сжижается при температуре ниже +21°С, превращаясь в желтоватую жидкость |
|
Пентаоксид диазота или оксид азота (V) |
N2O5 |
– Дегидратация азотной кислоты в присутствии оксида фосфора: 2HNO3 + P2O5 → 2HPO3 + N2O5; – взаимодействие хлора и нитрата серебра: 4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2; – реакция оксида азота (IV) и озона: 2NO2 + O3 → N2O5 + O2 |
Бесцветное твёрдое кристаллическое соединение, крайне неустойчивое при нормальных условиях. Приобретает стабильную форму при температуре ниже +10°C |
 Рис. 2. Диоксид или оксид азота (IV).
Рис. 2. Диоксид или оксид азота (IV).
Помимо пяти стабильных оксидов азота известны ещё пять нестабильных соединений – NON3, NO2N3, N(NO2)3, нитратный радикал NO3 и димер, состоящий из двух простых молекул, диоксида азота (N2O4).
Начнем с определения
Закись азота (формула N2O), также известен, как «NITRO» (Nitrous Oxide System) — это негорючий, бесцветный газ, со слабым приятным запахом и сладковатым вкусом. Его применяют и в медицине, там он называется «веселящий газ», воздействует на человека опьяняюще. При высоких температурах (около 500 градусов Цельсия), разлагается 2N2O=2N2 + 2O, является очень сильным окислителем, соответственно отлично поддерживает горение.

В автомобилях закись азота, как правило «упаковывается» в специальные баллоны, где находится под давлением.

Эта смесь не взрывается, и уж тем более не прожигает клапана – поршни, это своего рода достаточно дешевый способ кратковременного увеличения КПД двигателя и соответственно его мощности.
Влияние веселящего газа на организм
Бесцветный веселящий газ оказывает на человека легкий опьяняющий эффект, вызывает чувство расслабления, поднимает настроение. Такие реакции краткосрочны и быстро проходят, как только вы перестаете вдыхать смесь. В отдельных случаях газ может оказать на организм иное действие. Использование азотной закиси имеет ряд противопоказаний:
- Выраженная гипоксия;
- Заболевания ЦНС в тяжелой форме;
- Хронический алкоголизм;
- Состояние алкогольного опьянения.
При передозировке возможна потеря сознания, головокружение и головная боль. Если вы используете закись азота на вечеринке в клубе, высока вероятность, что вам не сумеют оказать должную помощь.
Чтобы снизить риск вредного воздействия, необходимо внимательно относится к качеству приобретаемого товара, а лучше воздержаться от подобного употребления.

Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
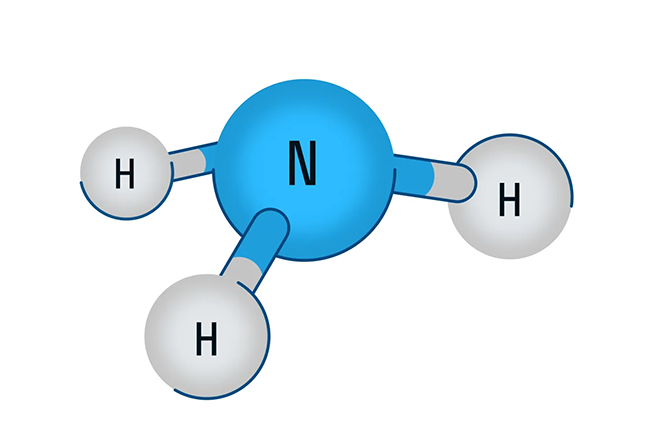
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
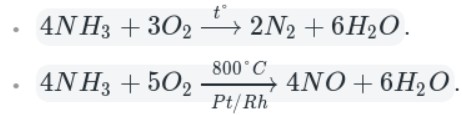
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
-
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
-
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
-
NH3 + HCl = NH4Cl
-
NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
-
Промышленный способ — синтез из простых веществ:
-
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
-
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O -
Окисление оксида азота (II)
2NO + O2 = 2NO2 -
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
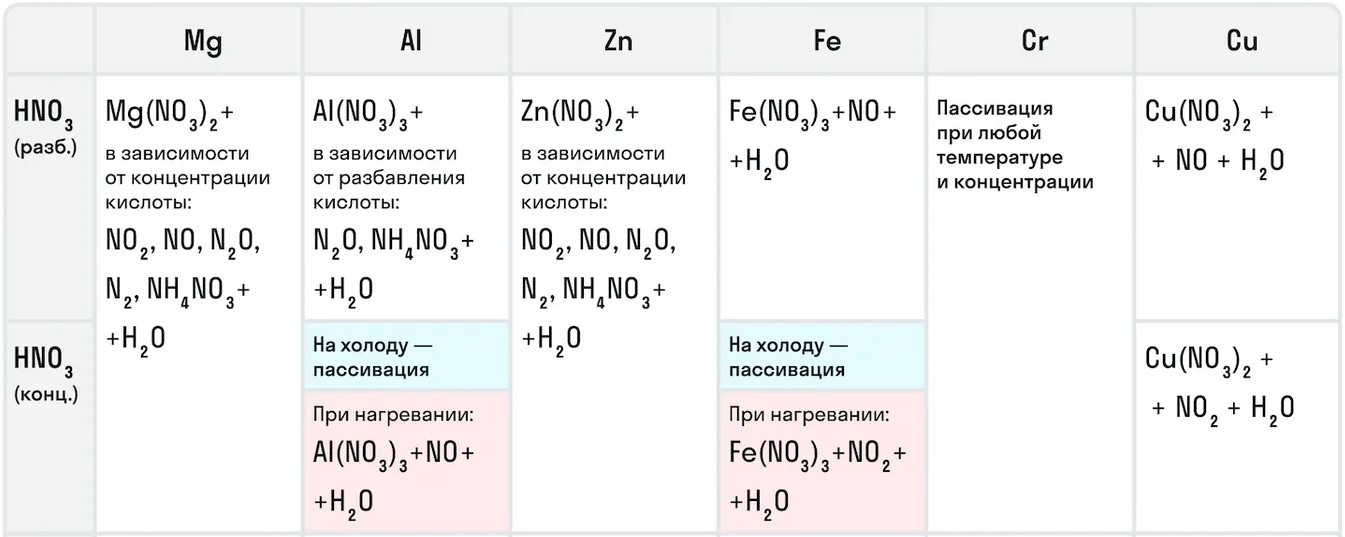
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
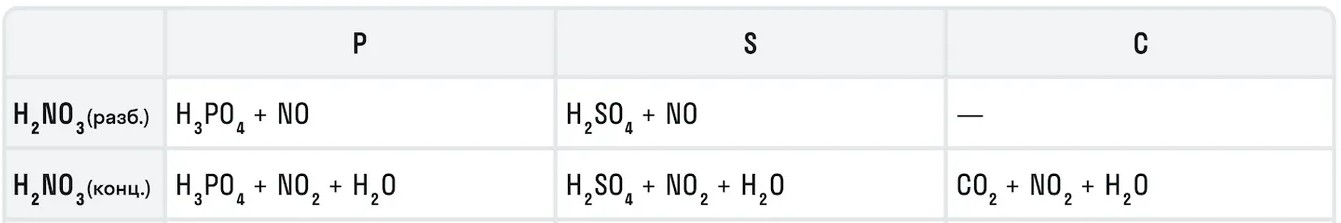
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
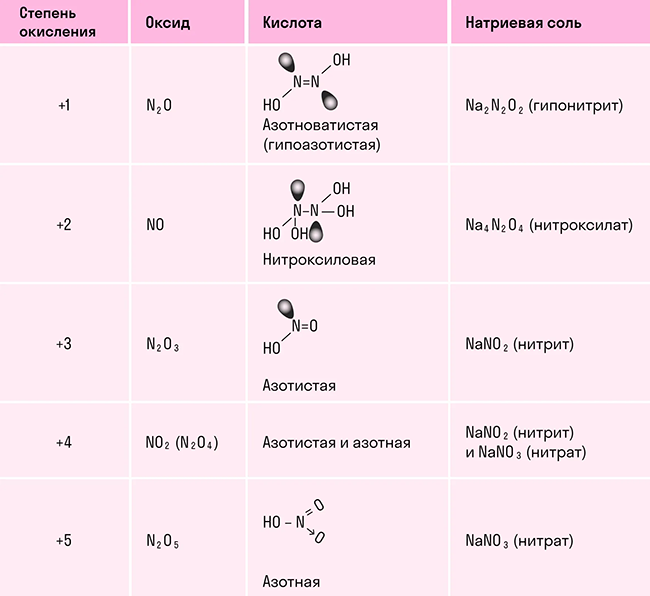
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
-
с фтором
N2 + F2 = 2NF3 -
с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
-
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
-
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
-
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O -
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Признаки употребления
Первыми признаками могут оказаться ссадины на теле и синяки. Если человек вдохнет большое количество закиси, полностью погрузившись в наркоз, устоять ему на месте просто не удастся, он непременно упадет на землю и травмирует себя.
При передозировке веселящим газом, может сформироваться асфиксия – кислородное голодание и за этим последовать смерть. Наркотическое опьянение веселящим газом длится примерно 30 минут, при повторном вдыхании оно может длиться до нескольких часов. По силе напоминает алкогольное включающее в себя:
- существенное улучшение настроения;
- легкое головокружение и шум;
- приятную волну тепла по телу;
- расслабленность, смех, веселье;
- беспечность.
Именно в эти моменты у человека происходят галлюциногенные проявления и преимущественно приятные. Краски вокруг становятся яркими, звуки – четкими, прилив сил – зашкаливает.

Принцип работы закиси азота
Подачу этого газа осуществляют непосредственно с топливной смесью в камеры сгорания. В верхней точке, когда поршень сжимает смесь, а свеча зажигает ее, происходит следующее:
1) Закись при воздействии высокого давления и температуры распадается на азот и кислород.
2) Таким образом, появляется возможность сжечь еще больше кислорода. А как известно бензин соединяясь с кислородом образует горючий состав.
3) Так вот — кислорода в N2O в 1,5 – 2 раза больше чем в обычном воздухе. Таким образом, сжигаем намного больше рабочего состава – что и придает мощности двигателю.
4) Азот же, также играет не маловажную роль, он улучшает детонационные свойства и не дает развиться процессу горения мгновенно, то есть просто не дает ему взорваться. Еще один плюс это снижение температуры поступающего воздуха, что делает его более плотным, что улучшает его сгорание в цилиндрах двигателя.
Надеюсь, поняли! Если сказать простыми словами, то получается закись азота это своеобразный катализатор горения. Который, позволяет получать больше топлива и лучше ему сгорать, этим и достигается прибавление мощности
Важно отметить, что настройки должны быть очень точными, при неправильных — двигатель может получать обедненную смесь, что приведет к его быстрому перегреву, ведь обороты здесь высокие. А перегрев опасен сам по себе
ИТОГ
Как видите закись азота – не взрывается, не разрушает-оплавляет двигатель внутри
Однако важно понимать, что на стандартный мотор поставить ее не всегда целесообразно. Потому как он просто может не выдержать нагрузки!

Если делать все правильно, на «подготовленном» двигателе, эта система дает очень хорошие результаты, за малые деньги. Причем она безопасна для большинства таких прокаченных агрегатов.
Насчет стоимости – самая дешевая из всех систем это «сухая», прокачка таким способом авто, намного дешевле внутренней переделки. Главное все делать с умом.
Сейчас небольшой ролик в тему, смотрим.
Буду заканчивать, читайте наш АВТОБЛОГ, будет еще много интересного.









