Химические свойства этиленгликоля, формула и класс вещества, применение в автомобиле
Содержание:
- К какому классу соединений относится этиленгликоль?
- Уникальные свойства этиленгликоля
- Использование этиленгликоля
- Обмен гидроксила на галоген
- Основные области применения
- Меры безопасности [ править | править код ]
- Как можно отравиться?
- Об этиленгликоле
- Клинические данные
- Теплоносители в системах отопления
- Амины
- Этиленгликоль – токсичный двухатомный спирт
- Разница между этиленгликолем и полиэтиленгликолем
- Спирт и его виды
- Первая помощь и выведение вещества из организма
- Производство
- Что такое этиленгликоль
- Промышленное применение этиленгликоля
К какому классу соединений относится этиленгликоль?
16.12.2016 05:20
Использование этиленгликоля уверенно завоевывает огромную популярность в самых разных сферах промышленности. Это связано с легкостью его выработки и свойствами вещества. Что такое этиленгликоль и какой класс органических соединений? Бесцветная маслянистая жидкость не имеющая запаха сладковатая на вкус и относящаяся к классу многоатомных спиртов как раз и называется этиленгликолем. Она токсичная и отравление этим веществом может привести к летальному исходу. Однако спешим уверить, соблюдение правил безопасности при работе с продуктами на основе этиленгликоля исключает возможность угрозы, поэтому их нужно строго придерживаться.
Отравиться этиленгликолем можно и при употреблении внутрь, и при вдыхании паров. Первое делать ни в коем случае нельзя, от второго можно защититься специальными масками, которые рекомендуют надевать при тесном контакте с веществом.
Уникальные свойства этиленгликоля
-
Прекрасная растворимость в воде с абсолютно любой концентрацией (0%-100%).
-
Придание раствору особого качества: замерзание только при очень низких температурах (каких именно, напрямую зависит от концентрации вещества).
-
Гигроскопичность — прекрасно впитывает влагу и осушает поверхности.
-
Растворение в воде плохо или вообще нерастворимых веществ (гидрофобных и гидрофильных).
Использование этиленгликоля
-
Автомобильные антифризы.
-
Теплоноситель и хладоноситель (системы отопления, установки пищевой промышленности и так далее).
-
Производство разнообразных полимеров (полиуретан, целлофан и другие).
-
Растворитель красок.
-
В авиационном топливе.
-
Производство конденсаторов.
-
Криопротектор.
-
Для изготовления взрывчатого вещества нитрогликоля.
-
Системы чиллер-фанкойл (кондиционирование воздуха) — в качестве теплоносителя.
-
Крема для обуви (один из компонентов часто используемого товара).
-
Жидкость для мытья стекол (тоже один из компонентов).
Это еще не весь список продуктов, в состав которых входит этиленгликоль. Данное вещество применяется в лакокрасочной, косметической, металлургической, печатной и даже текстильной промышленности. Многие олифы, краски, эмали, смолы, защитные жидкости для кожи не обходятся без этиленгликоля. Эфиры этого вещества активно используют в создании косметических средств и парфюмерии.
Ценность этиленгликоля высока, поэтому сегодня его продают в чистом виде в большом количестве, благодаря чему активно развиваются разные сферы промышленности.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
НО-СН2-СН2-ОН + 2НХ → Х-СН2-СН2-Х, где Х – хлор или бром.
Источники
- https://carnovato.ru/jetilenglikol-klass-opasnosti-himicheskie-svojstva-primenenie/
- https://sigarety-sklad.ru/otlichie-propilenglikolya-etil/
- https://forwardgr.ru/katalog/trietilenglikol
- https://tdslav.ru/p/trietilenglikol
- https://motorstory.ru/medicina/fizicheskie-i-ximicheskie-svojstva-etilenglikolya-formula/
- https://him-kazan.ru/stati/propilenglikol-ili-etilenglikol
- https://fb.ru/article/194634/himicheskie-svoystva-etilenglikolya-harakteristika-dvuhatomnyiy-spirt-efiryi-etilenglikolya
Основные области применения
Пропиленгликоль используется практически во всех современных сферах производства.
- Фармацевтической промышленности.
- Лакокрасочной.
- Химической.
- Нефтедобывающей
Пропиленгликоль может входить в состав отдельных смазочных веществ, полимерных пластмасс, антиобледенителей, применяемых в теплоносителях, а также в отдельных веществах, служащих как для производственных целей, так и для решения бытовых задач.
- В роли антифриза в системах отопления, вентилирования и кондиционирования. Данные агрегаты могут быть установлены как на производстве, так и дома.
- Используется для изготовления алкидных и полиэфирных смол для автомобильной и строительной отраслей.
- Часто пропиленгликоль может быть в веществах, созданных в фармацевтике и косметологии.
Гликоли относятся к категории пожароопасных и взрывоопасных материалов. Поэтому во время работы с пропиленгликолем необходимо соблюдать основные правила безопасности, чтобы избежать неприятностей и создания аварийных ситуаций.
- Все емкости, в которых хранится вещество должны быть герметичны и плотно закрыты, чтобы избежать пролива и выплескивания во время транспортирования.
- Во время работы с веществом необходимо применять все средства индивидуальной защиты.
- Крайне рекомендуется закрыть органы дыхания, чтобы предотвратить проникновение паров в легкие.
- Закрыть открытые участки тела, чтобы избежать химических ожогов и травм.
Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Как можно отравиться?
Этиленгликолем можно отравиться двумя способами:
- При вдыхании его паров;
- При употреблении внутрь;
- Через кожные покровы.
Попадание через дыхательные пути случается, как правило, на производстве в результате аварии, нарушения технологии производства и несоблюдения индивидуальных мер защиты. Этиленгликоль очень летуч, поэтому высокой концентрации в воздухе практически не создается, а отравления таким путем носят хронический характер – периодическое вдыхание небольших доз паров вещества.Другой, наиболее опасный и частый путь отравления – прием вещества внутрь. Это может быть случайно, когда этиленгликоль хранится в бутылке из-под напитков, или оставлен в доступном для детей месте. Но чаще всего подобные отравления случаются с людьми с алкогольной зависимостью, которые умышленно принимают его для опьянения. С этой целью его также получают в домашних условиях путем перегонки через аппарат-дистиллятор антифриза или тормозной жидкости. Отсутствие какого-либо запаха и сладковатый привкус вводят в заблуждение, что этот «аналог» этилового спирта не опасен, что и приводит к передозировке.
Попадание через кожные покровы встречается довольно редко, только при длительном прямом контакте с жидкостью, при этом интоксикация бывает не сильно выражена.
Об этиленгликоле
В качестве присадки применяться может этиленгликоль для систем отопления.
Закипает он при температуре 197,9°C; плавится – при 12,6°C. Смешивается с водой и спиртом.
Опасен для здоровья!
Этиленгликоль является токсичным веществом. Степень вреда, который он может принести человеку, зависит от: чувствительности организма, объема вещества, состояния, в котором на момент попадания этиленгликоля внутрь, находится нервная система, наполненности желудка.
Стать причиной смерти может и не очень большое количество этиленгликоля – 50 мл. Некоторые утверждают, что отравиться можно от 50-150 мл этого вещества.
Об этом следует знать, прежде чем теплоноситель для системы отопления купить
Как видно, жидкость в систему отопления дома должна выбираться осторожно. То, каким именно образом происходит токсичное действие этиленгликоля неизвестно до сих пор. Известно, что кровь быстро впитывает этиленгликоль
Кстати, проникать в организм он может и сквозь поры. Несколько часов вещество циркулирует по кровеносной системе, не растворяясь. Пик концентрации наступает через 2-5 часов после попадания этиленгликоля в организм. Далее содержание вещества в крови уменьшается, и он начинает фиксироваться в тканях
Известно, что кровь быстро впитывает этиленгликоль. Кстати, проникать в организм он может и сквозь поры. Несколько часов вещество циркулирует по кровеносной системе, не растворяясь. Пик концентрации наступает через 2-5 часов после попадания этиленгликоля в организм. Далее содержание вещества в крови уменьшается, и он начинает фиксироваться в тканях.
Действие этиленгликоля двухфазное. Если отравленный человек не погибает по истечении короткого промежутка времени, далее следует сильное поражение организма.

Клинические данные
- Интоксикация первые 3-4 часа (как с этанолом) часто со снижением сознания, тошнотой, рвотой и атаксией.
- Ацидоз из-за гликозиловой кислоты через 3-4 часа.
- Гипервентиляция, тахикардия и гипертония.
- Тяжелый ацидоз может вызвать гипотензию, кому и остановку дыхания.
- Судороги, возможно, отек диска зрительного нерва.
- Острая олигурическая почечная недостаточность.
Дополнительные исследования
· Определение уровня глюкозы поможет исключить или подтвердить гипогликемию.
· Анализ крови укажет на тиленгликоль в плазме.
· Разрыв осмоляльности (расчет разрыва осмоляльности) увеличивается при отравлении.
· Расчет электролитов и анионного зазора (расчет анионного зазора) увеличивается.
· Кислотное / основное состояние и газы крови: метаболический ацидоз, ионизированный кальций, гипокальциемия, креатинин.
· Микроскопия анализа крови укажет на кристаллы (может пройти некоторое время, прежде чем они сформируются). Кристаллы бывают 2 типов: игольчатый (оксалат кальция) и конверт формы.
Пациент с подозрением на отравление этиленгликолем должен быть немедленно госпитализирован и обследован.
Теплоносители в системах отопления
Состав любого теплоносителя условно можно разделить на четыре составляющие. К ним относятся:

- основа (одна из разновидностей гликолей и полигликолей);
- красители;
- пакет присадок;
- специально подготовленная деминерализованная (дистиллированная) вода.
В состав основы может входить один из трёх спиртов: глицерин, пропиленгликоль, этиленгликоль. Разумеется, если просто перемешать все эти компоненты в домашних условиях, то вместо теплоносителя можно получить бесполезную цветную жидкость с нерастворённой взвесью. Производство теплоносителя — это сложный процесс, осуществляемый в промышленных условиях с соблюдением ГОСТа, многочисленных рецептур и технических требований под контролем высококвалифицированных специалистов.
Основные плюсы этандиола
Отличительной характеристикой теплоносителя на основе этиленгликоля является то, что он устойчив к низким температурам и замерзает при -65 градусах (в зависимости от концентрации). Входящие в их состав присадки предотвращают образование накипи и коррозии в трубах. В отличие от других теплоносителей, например, воды, водногликолевые растворы при замерзании расширяются всего на 1,5−2%, что не оказывает негативного влияния на работу тепловых систем.
Обычно чистый концентрат никогда не заливают и смешивают его с дистиллированной водой в пропорции 60 на 40 или 50/50.
Между моноэтиленгликолем и этиленгликолем разницы практически нет — это прозрачная вязкая жидкость, относящаяся к спиртам. К минусам такого теплоносителя относят его токсичность. Попадание 0,1 литра этой жидкости внутрь организма может привести к летальному исходу. Однако при соблюдении эксплуатационных требований и герметичности контура его утечек можно избежать. Всё же по некоторым предписаниям он не применяется в системах отопления детского сада и в некоторых других муниципальных и технических объектах, т. к. в случае утечки это может привести к отравлению людей.
Альтернативная жидкость
Как следствие, позже был изобретён теплоноситель на основе пропиленгликоля. Отличить его можно по специальной маркировке, на которой указана температура замерзания (до минус 30). Пропиленгликоль используется для производства массы продуктов не только в химической, но и в пищевой промышленности. Из него производят добавку Е1520, а также при смешивании с глицерином 50/50 добавляют в электронные сигареты. Иными словами, он совершенно безвреден.

Единственным его минусом является цена, т. к. у такого экологического теплоносителя она будет в два раза больше. Фактически 10 кг этиленгликоля и пропиленгликоля стоят одинаково, однако первый можно разводить с водой почти в два раза, что является намного выгоднее.
У теплоносителя как на основе этиленгликоля, так и на основе пропиленгликоля теплоёмкость гораздо ниже. Соответственно, при проектировании системы отопления следует закладывать большее количество секций радиаторов для создания большей теплоотдачи. Вязкость и плотность у этих теплоносителей также в два-три раза выше, чем у воды, поэтому циркуляционные насосы также следует закладывать больше и мощнее.
Это не касается домов большой площади, т. к. там уже рассчитаны насосы с больши́м запасом.
У пропиленгликоля довольно большое объёмное расширение, и расширительный бак для него необходим большего размера. Кроме того, эти спирты запрещают использовать в качестве теплоносителей большинство производителей газовых и электрических котлов, т. к. их кислотность не всегда совместима с прокладками и теплообменниками. Они также не очень хорошо «дружат» с алюминиевыми радиаторами и межсекционными прокладками, опять же из-за высокой кислотности. Во время эксплуатации их будет разъедать. Отсюда лучше использовать либо литые, либо стальные панельные радиаторы.

Так как этиленгликоль является ядовитым веществом, то утилизировать теплоноситель на его основе (после окончания срока службы) необходимо специальным способом. Существуют определённые компании, которые занимаются его утилизацией. Попросту сливать этиленгликоль в почву крайне не рекомендуется.
Конечно, для хорошей циркуляции по узким каналам отопительного оборудования необходим теплоноситель с самой лучшей текучестью и минимальной вязкостью
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Этиленгликоль – токсичный двухатомный спирт
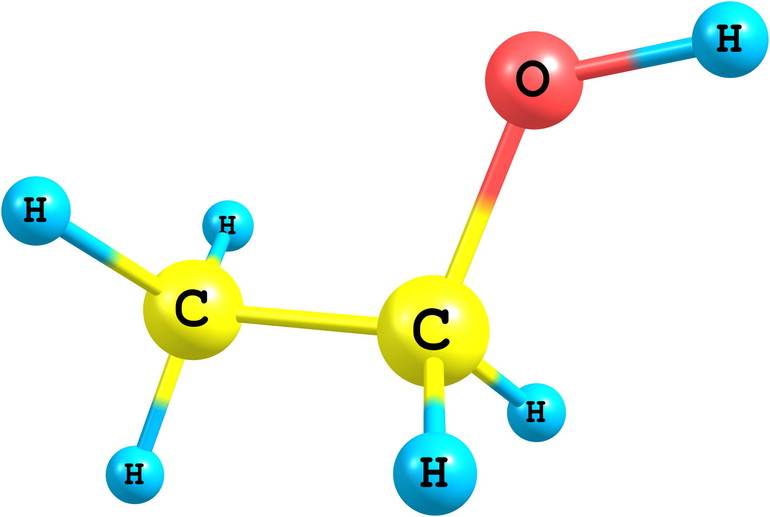
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел);
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.
Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к смерти. При однократном употреблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.
Пары данного соединения менее токсичны. Так как этиленгликоль характеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
Разница между этиленгликолем и полиэтиленгликолем
Определение
Этиленгликоль: Этиленгликоль представляет собой бесцветное спиртовое соединение без запаха, имеющее химическую формулу C2ЧАС6О2.
Полиэтиленгликоль: Полиэтиленгликоль является полиэфирным соединением, что означает, что он имеет много эфирных групп.
Общая формула
Этиленгликоль: Общая формула для этиленгликоля является C2ЧАС6О2.
Полиэтиленгликоль: Общая формула для полиэтиленгликоля H- (O-CH2-СН2)N-ОН.
производство
Этиленгликоль: Этиленгликоль получают в результате реакции между этиленоксидом и водой.
Полиэтиленгликоль: Полиэтиленгликоль получают в результате реакции между этиленоксидом и водой, этиленгликолем или олигомерами этиленгликоля.
Молекулярный вес
Этиленгликоль: Молекулярная масса этиленгликоля составляет около 62,07 г / моль.
Полиэтиленгликоль: Молекулярная масса полиэтиленгликоля зависит от значения «n» в его общей формуле.
Пользы
Этиленгликоль: Этиленгликоль в основном используется для производства полиэфирных волокон и в качестве автомобильного антифриза.
Полиэтиленгликоль: Полиэтиленгликоль имеет множество применений, включая медицинские, химические, биологические, промышленные и т. Д.
Заключение
И этиленгликоль, и полиэтиленгликоль коммерчески очень важны и используются в ряде областей применения. Этиленгликоль представляет собой сиропообразную жидкость при комнатной температуре, тогда как полиэтиленгликоль представляет собой твердый материал. Основное различие между этиленгликолем и полиэтиленгликолем заключается в том, что этиленгликоль имеет фиксированное значение молекулярной массы, тогда как полиэтиленгликоль не имеет фиксированной величины молекулярной массы.
Спирт и его виды
Именно английское «Spirit» лежит в основании русского названия «спирт». Это вещество представляет собой органический продукт (производное углеводов), в химической формуле которого содержится гидроксильная группа. Существуют разные классификации спиртов. Согласно одной из них различают одноатомные, двухатомные и многоатомные вещества. Также химики группируют их на ненасыщенные, насыщенные и ароматические. Еще одна классификация предусматривает разделение спиртов на первичные и вторичные. Простой спирт – это жидкость без цвета, но с характерным запахом и вкусом, легко растворяемая водой в любых пропорциях. И чем больше атомов в спиртах, тем легче они соединяются с водой. А вот для маслянистых и жиросодержащих веществ спирт и сам служит растворителем.
В природе это вещество содержится, как правило, в составе эфирных масел. В листьях многих растений содержится метиловый спирт. После брожения органических продуктов образуется этиловый спирт. Кстати, к этой категории веществ относят также и некоторые витамины, например, А, D, В8.
Химики определяют спирт, как вещество, полученное в результате гидрогенизации окиси углерода под воздействием катализаторов. Чаще всего в разных сферах жизнедеятельности используют такие спирты:
Первая помощь и выведение вещества из организма
Алгоритм действий по оказанию помощи человеку, выпившему этиленгликоль или жидкость, его содержащую, таков:
- Вызвать бригаду скорой помощи;
- Промыть желудок содовым раствором (1 столовая ложка на 0,5 л воды);
- Давать обильное теплое питье: молоко, минеральная вода без газа;
- Дать выпить сорбент (активированный уголь, полисорб, энтеросгель);
- Дать слабительное, лучше всего подойдет магнезия.
Если пострадавший в сознании, и его состояние не тяжелое, хорошо дать выпить 100 мл водки или 50 мл медицинского спирта, разбавленного пополам с водой. Как это ни покажется странным, этиловый спирт является антидотом этого токсичного вещества, который можно применить в домашних условиях.
Если пострадавший без сознания, его нужно уложить на ровную поверхность, повернув голову набок во избежание асфиксии содержимым желудка в случае рвоты. Необходимо прощупать пульс и измерить давление. Пульс может быть нитевидным и даже не прощупываться на запястье, определять его нужно на сонных артериях – боковой поверхности шеи.
В случае остановки дыхания и отсутствия пульса нужно выполнить закрытый массаж сердца и принудительное искусственное дыхание.
В стационаре в качестве антидота при отравлении этиленгликолем вводится внутривенно стерильный щелочной раствор – бикарбонат натрия (сода), вводится глюконат кальция для восполнения его потери. Проводится восстановительная терапия, в зависимости от степени возникших нарушений. При тяжелом отравлении для очистки крови подключают аппарат гемосорбции (искусственная почка).
Производство
Промышленные маршруты
Этиленгликоль производят из этилена (этен), через промежуточное соединение этиленоксид. Оксид этилена реагирует с водой с образованием этиленгликоля в соответствии с химическим уравнением :
- C2H4O + H 2 O → HO-CH 2CH2-OH
Это реакция может катализироваться либо кислотами, либо основаниями, или может протекать при нейтральном pH при повышенных температурах. Наибольший выход этиленгликоля происходит при кислом или нейтральном pH с большим избытком воды. В этих условиях можно достичь выхода этиленгликоля 90%. Основными побочными продуктами являются олигомеры диэтиленгликоль, триэтиленгликоль и тетраэтиленгликоль. Разделение этих олигомеров и воды требует больших затрат энергии. Ежегодно производится около 6,7 миллионов тонн.
Более высокая селективность достигается за счет использования процесса OMEGA компании Shell. В процессе OMEGA оксид этилена сначала преобразуется с помощью диоксида углерода (CO. 2) в этиленкарбонат. Затем это кольцо гидролизуют основным катализатором на второй стадии с получением моноэтиленгликоля с селективностью 98%. На этом этапе снова выделяется диоксид углерода, который может быть снова подан в технологический контур. Углекислый газ частично поступает из производства окиси этилена, где часть этилена полностью окисляется.
Этиленгликоль получают из окиси углерода в странах с большими запасами угля и менее строгими экологическими нормами. Окислительное карбонилирование метанола до диметилоксалата обеспечивает многообещающий подход к получению этиленгликоля на основе C 1. Диметилоксалат может быть преобразован в этиленгликоль с высокими выходами (94,7%) путем гидрирования с медным катализатором:
Поскольку метанол рециркулирует, потребляются только монооксид углерода, водород и кислород. Один завод с производственной мощностью 200 000 тонн этиленгликоля в год находится во Внутренней Монголии, а второй завод в китайской провинции Хэнань мощностью 250 000 тонн в год. год был намечен на 2012 год. По состоянию на 2015 год четыре завода в Китае мощностью 200 000 т / год каждый работали, и еще не менее 17 в будущем.
Биологические маршруты
55>гусеница большой восковой моли, Galleria mellonella, имеет кишечные бактерии, способные разлагать полиэтилен (PE) до этиленгликоля. 211>
Исторические маршруты
Согласно большинству источников, французский химик Шарль-Адольф Вюрц (1817–1884) впервые получил этиленгликоль в 1856 году. Он первым обработал «иодид этилена» ( C 2H4I2) ацетатом серебра и затем гидролизовали полученный «этилендиацетат» гидроксидом калия. Вюрц назвал свое новое соединение «гликоль», потому что он имеет общие свойства как с этиловым спиртом (с одной гидроксильной группой), так и с глицерином (с тремя гидроксильными группами). В 1859 году Вюрц получил этиленгликоль путем гидратации этиленоксида. По всей видимости, коммерческое производство или применение этиленгликоля не производилось до Первой мировой войны, когда он был синтезирован из этилендихлорида в Германии и использован в качестве заменителя глицерина. в индустрии взрывчатых веществ.
В Соединенных Штатах полукоммерческое производство этиленгликоля через этиленхлоргидрин началось в 1917 году. Первый крупномасштабный коммерческий завод по производству гликоля был построен в 1925 году в Южном Чарльстоне, Западная Вирджиния., компанией Carbide and Carbon Chemicals Co. (ныне Union Carbide Corp.). К 1929 году этиленгликоль использовался почти всеми производителями динамита. В 1937 году компания Carbide запустила первую установку, основанную на процессе Лефорта, для парофазного окисления этилена до окиси этилена. Carbide сохранял монополию на процесс прямого окисления до 1953 года, когда процесс научного проектирования был коммерциализирован и предложен для лицензирования.
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Промышленное применение этиленгликоля
Этандиол используется для производства различных материалов и веществ. К ним относятся:

- охлаждающие жидкости и антифризы на основе этиленгликоля;
- целлофаны;
- полиуретаны;
- конденсаторы;
- тормозные жидкости;
- теплоносители.
В частности, он активно применяется для создания антифризов. Продукт на основе этого спирта не замерзает, даже если его охлаждать до -40. Вещество становится только более вязким, сохраняя при этом свою текучесть. Для того чтобы полностью кристаллизоваться, температура нужна ещё ниже, потому что процесс кристаллизации у него довольно длительный.