Применение многоатомных спиртов и общая формула по химии
Содержание:
- Строение и структура соединения
- Физические и теплофизическине свойства водных растворов глицерина
- Плотность водного раствора глицерина в зависимости от температуры и концентрации. Таблица.
- Концентрация глицерина по массе и по объёму в водном растворе
- Температура кипения смеси глицерина с водой (при нормальном атмосферном давлении)
- Температура замерзания смеси глицерина с водой (при нормальном атмосферном давлении)
- Особенности теплоносителей на основе этиленгликоля
- Теплоносители в системах отопления
- Первая помощь
- Области применения и ценовая политика продукционного ряда
- Методы получения
- Что такое этиленгликоль?
- Разница между этиленгликолем и полиэтиленгликолем
- Строение и структура соединения
- Что такое этиленгликоль
- Физические характеристики
- этан-1,2-диол
- этан-1,2-диол
Строение и структура соединения
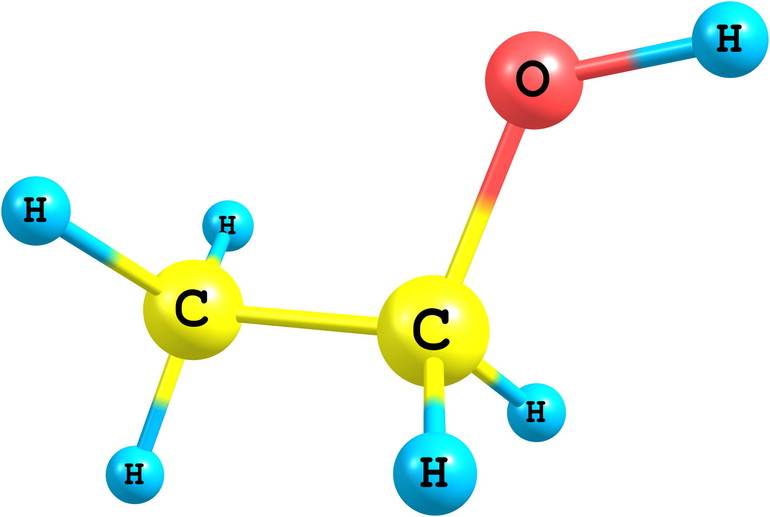
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие транс-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Физические и теплофизическине свойства водных растворов глицерина
Плотность водного раствора глицерина в зависимости от температуры и концентрации. Таблица.
Плотность смеси глицерина и воды приведена в таблице для концентрации глицерина от 10% до 70% по массе в диапазоне температур от нуля до ста градусов Цельсия.
| Температура, °C | Плотность водного раствора глицерина (содержание в процентах по массе) / ρ, г/см3 | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 1,025 | 1,052 | 1,079 | 1,107 | 1,135 | 1,163 | 1,192 | |
| 20 | 1,022 | 1,047 | 1,073 | 1,099 | 1,126 | 1,154 | 1,181 |
| 40 | 1,016 | 1,039 | 1,064 | 1,089 | 1,115 | 1,142 | 1,169 |
| 60 | 1,006 | 1,030 | 1,053 | 1,078 | 1,103 | 1,130 | 1,156 |
| 80 | 0,994 | 1,017 | 1,041 | 1,066 | 1.091 | 1,117 | 1.144 |
| 100 | 0,982 | 1,004 | 1,027 | 1,052 | 1,077 | 1,104 | 1,302 |
Вязкость водного раствора глицерина приводится в таблице в диапазоне температур смеси от нуля до ста градусов Цельсия и концентрации глицерина от 10% до 70%. Примечательно, что добавление всего лишь 10% (по массе) глицерина в воду позволяет повысить динамическую вязкость раствора на 30%.
| Температура, °C | Вязкость абсолютная (динамическая) водного раствора глицерина (содержание в процентах по массе) μ, Па*с | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 2,44*10-3 | 3,44*10-3 | 5,14*10-3 | 8,25*10-3 | 14,6*10-3 | 29,9*10-3 | 76,0*10-3 | |
| 20 | 1,31*10-3 | 1,76*10-3 | 2,5*10-3 | 3,72*10-3 | 6,0*10-3 | 10,8*10-3 | 22,5*10-3 |
| 40 | 0,826*10-3 | 1,07*10-3 | 1,46*10-3 | 2,07*10-3 | 3,10*10-3 | 5,08*10-3 | 9,4*10-3 |
| 60 | 0,575*10-3 | 0,731*10-3 | 0,956*10-3 | 1,30*10-3 | 1,86*10-3 | 2,85*10-3 | 4,86*10-3 |
| 80 | — | — | 0,69*10-3 | 0,918*10-3 | 1,25*10-3 | 1,84*10-3 | 2,9*10-3 |
| 100 | — | — | — | 0,668*10-3 | 0,91*10-3 | 1,28*10-3 | 1,93*10-3 |
Значения теплопроводности водного раствора глицерина показаны в таблице для диапазона температур от 20 до 80 градусов Цельсия и концентрации глицерина от 10% до 70%. С увеличением концентрации глицерина теплопроводность водного раствора снижается. При содержании 50% глицерина теплопроводность смеси примерно на 29% меньшей, чем у чистой воды.
| Температура | Теплопроводность смеси глицерина (содержание в процентах по массе) с водой Вт/(м*°C) | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 20 | 0,557 | 0,519 | 0,481 | 0,448 | 0,414 | 0,381 | 0,352 |
| 40 | 0,586 | 0,540 | 0,502 | 0,460 | 0,423 | 0,385 | 0,356 |
| 60 | 0,611 | 0,565 | 0,519 | 0,477 | 0,435 | 0,393 | 0,360 |
| 80 | 0,636 | 0,590 | 0,540 | 0,494 | 0,448 | 0,402 | 0,364 |
Оценочные значения теплоемкости водного раствора глицерина приводятся в таблице для температур от 20 до 80 градусов Цельсия и концентраций глицерина от 10 до 70%. С увеличением концентрации глицерина теплопроводность раствора снижается. При нормальных условиях и содержании 10% глицерина теплоемкость смеси примерно в 2 раза меньше теплоемкости чистой воды.
| Температура, °С | Теплоемкость смеси глицерина (содержание в процентах по массе) с водой кДж/(кг*°C) | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 20 | 1,998 | 1,907 | 1,816 | 1,725 | 1,634 | 1,542 | 1,452 |
| 40 | 2,002 | 1,916 | 1,830 | 1,744 | 1,659 | 1,573 | 1,487 |
| 60 | 2,010 | 1,929 | 1,848 | 1,767 | 1,687 | 1,606 | 1,525 |
| 80 | 2,024 | 1,948 | 1,871 | 1,795 | 1,718 | 1,642 | 1,608 |
Концентрация глицерина по массе и по объёму в водном растворе
В таблице ниже приведены соотношения концентрации глицерина в водном растворе по массе и по объёму.
| Концентрация глицерина в водном растворе по массе | 5% | 10% | 20% | 30% | 40% | 50% | 60% | 70% |
| Концентрация глицерина по объёму в водном растворе | 4,0% | 8,1% | 16,58% | 25,49% | 34,84% | 44,63% | 54,86% | 65,56% |
Температура кипения смеси глицерина с водой (при нормальном атмосферном давлении)
- Вода (без глицерина): 100°C
- Вода (90%) + Глицерин (10%): 100.7°C
- Вода (70%) + Глицерин (30%): 102,9°C
- Вода (50%) + Глицерин (50%): 106,7°C
- Глицерин (80%) + Вода (20%): 121,5°C
- Глицерин (90%) + Вода (10%): 139,8°C
- Глицерин (95%) + Вода (5%): 168 °C
Температура замерзания смеси глицерина с водой (при нормальном атмосферном давлении)
Источник, в основном: Богданов, Бурцев, Иванов, Куприянова «Холодильная Техника, Кондиционирование воздуха. Свойства веществ. » СПб. 1999
- Вода (90%) + Глицерин (10%): -2,2°C
- Вода (70%) + Глицерин (30%): -8,8°C
- Вода (50%) + Глицерин (50%): -21,4°C
- Глицерин (70%) + Вода (30%): -41,5°C
Особенности теплоносителей на основе этиленгликоля
Этиленгликоль используется в системах отопления в виде водных растворов. В продаже имеются готовые теплоносители нужной концентрации и концентрированные растворы, которые необходимо разбавлять водой. Помимо растворителя и антифриза добавляются также присадки, меняющие температуру закипания и кристаллизации, снижающие коррозионное воздействие на элементы отопительного контура, придающие смесям цвет, для удобства поиска протечек в системе отопления. Растворы этиленгликоля используются в качестве теплоносителей и антифризов в следующих областях:
- в закрытых системах отопления частных жилых домов, некоторых промышленных зданий, административных сооружений, общественных заведений;
- в системах охлаждения мощных компьютеров и другой электронной техники;
- в качестве автомобильного антифриза и компонента тормозной жидкости.
Основными преимуществами водных растворов этиленгликоля являются их высокие теплофизические характеристики:
- высокая температура кипения предотвращает вскипание антифриза при перегреве системы отопления;
- из-за малого коэффициента расширения и аморфного характера затвердевания этиленгликолевой смеси при замерзании она не разрушает систему отопления, сохраняя ее герметичность;
- сравнительно высокая текучесть и теплопроводность этиленгликоля способствует более быстрому и эффективному распределению тепла по отопительной системе;
- относительно низкая стоимость (больше, чем у воды, но меньше по сравнению с пропиленгликолем);
- небольшая вязкость способствует лучшему распределению тепла, а также снижает нагрузку на элементы насосного оборудования;
- этиленгликолевые растворы практически не образуют твердых отложений солей в трубопроводе системы отопления, что продлевает ее эксплуатационный ресурс;
- температура замерзания 50–70-процентных теплоносителей на основе этиленгликоля составляет от -35 °С до -65 °С, что позволяет использовать их в регионах с экстремально низкими температурами;
- за счет использования дополнительных присадок, снижающих коррозионную активность этиленгликоля, растворы этого вещества не разрушают уплотнительные элементы отопительной системы.
У водно-этиленгликолевых растворов имеются и недостатки, ограничивающие их применение:
- высокая токсичность (третий класс опасности), обуславливающая тяжелое отравление при попадании внутрь организма, на кожу и слизистые оболочки;
- опасность для окружающей среды, из-за которой утечка теплоносителя приводит к отравлению почв и водоемов;
- значительное повышение вязкости при понижении температуры, вызывающая повышенную нагрузку и быстрый износ насосного оборудования;
- при полном выкипании воды из антифриза и последующем охлаждении высококонцентрированный этиленгликоль замерзает при температуре всего -13 °С, что может привести к аварийной ситуации;
- этиленгликолевые растворы без присадок оказывают коррозионное действие на металлические и резиновые элементы системы отопления, из-за чего возникают протечки теплоносителя.
Из-за указанных недостатков теплоносители на основе этиленгликоля рекомендуется использовать только в закрытых системах отопления, оснащенных расширительным баком. Их применение с условием постоянного контроля допускается на производственных предприятиях, складах, ограниченно – в жилых домах. Этиленгликоль не используется на объектах с повышенными требованиями к безопасности, в частности:
- на предприятиях пищевой и фармацевтической промышленности;
- в многоквартирных жилых домах;
- в двухконтурных системах отопления (для предотвращения смешивания этиленгликоля и нетехнической воды).
Теплоносители в системах отопления
Состав любого теплоносителя условно можно разделить на четыре составляющие. К ним относятся:

- основа (одна из разновидностей гликолей и полигликолей);
- красители;
- пакет присадок;
- специально подготовленная деминерализованная (дистиллированная) вода.
В состав основы может входить один из трёх спиртов: глицерин, пропиленгликоль, этиленгликоль. Разумеется, если просто перемешать все эти компоненты в домашних условиях, то вместо теплоносителя можно получить бесполезную цветную жидкость с нерастворённой взвесью. Производство теплоносителя — это сложный процесс, осуществляемый в промышленных условиях с соблюдением ГОСТа, многочисленных рецептур и технических требований под контролем высококвалифицированных специалистов.
Основные плюсы этандиола
Отличительной характеристикой теплоносителя на основе этиленгликоля является то, что он устойчив к низким температурам и замерзает при -65 градусах (в зависимости от концентрации). Входящие в их состав присадки предотвращают образование накипи и коррозии в трубах. В отличие от других теплоносителей, например, воды, водногликолевые растворы при замерзании расширяются всего на 1,5−2%, что не оказывает негативного влияния на работу тепловых систем.
Обычно чистый концентрат никогда не заливают и смешивают его с дистиллированной водой в пропорции 60 на 40 или 50/50.
Между моноэтиленгликолем и этиленгликолем разницы практически нет — это прозрачная вязкая жидкость, относящаяся к спиртам. К минусам такого теплоносителя относят его токсичность. Попадание 0,1 литра этой жидкости внутрь организма может привести к летальному исходу. Однако при соблюдении эксплуатационных требований и герметичности контура его утечек можно избежать. Всё же по некоторым предписаниям он не применяется в системах отопления детского сада и в некоторых других муниципальных и технических объектах, т. к. в случае утечки это может привести к отравлению людей.
Альтернативная жидкость
Как следствие, позже был изобретён теплоноситель на основе пропиленгликоля. Отличить его можно по специальной маркировке, на которой указана температура замерзания (до минус 30). Пропиленгликоль используется для производства массы продуктов не только в химической, но и в пищевой промышленности. Из него производят добавку Е1520, а также при смешивании с глицерином 50/50 добавляют в электронные сигареты. Иными словами, он совершенно безвреден.

Единственным его минусом является цена, т. к. у такого экологического теплоносителя она будет в два раза больше. Фактически 10 кг этиленгликоля и пропиленгликоля стоят одинаково, однако первый можно разводить с водой почти в два раза, что является намного выгоднее.
У теплоносителя как на основе этиленгликоля, так и на основе пропиленгликоля теплоёмкость гораздо ниже. Соответственно, при проектировании системы отопления следует закладывать большее количество секций радиаторов для создания большей теплоотдачи. Вязкость и плотность у этих теплоносителей также в два-три раза выше, чем у воды, поэтому циркуляционные насосы также следует закладывать больше и мощнее.
Это не касается домов большой площади, т. к. там уже рассчитаны насосы с больши́м запасом.
У пропиленгликоля довольно большое объёмное расширение, и расширительный бак для него необходим большего размера. Кроме того, эти спирты запрещают использовать в качестве теплоносителей большинство производителей газовых и электрических котлов, т. к. их кислотность не всегда совместима с прокладками и теплообменниками. Они также не очень хорошо «дружат» с алюминиевыми радиаторами и межсекционными прокладками, опять же из-за высокой кислотности. Во время эксплуатации их будет разъедать. Отсюда лучше использовать либо литые, либо стальные панельные радиаторы.

Так как этиленгликоль является ядовитым веществом, то утилизировать теплоноситель на его основе (после окончания срока службы) необходимо специальным способом. Существуют определённые компании, которые занимаются его утилизацией. Попросту сливать этиленгликоль в почву крайне не рекомендуется.
Конечно, для хорошей циркуляции по узким каналам отопительного оборудования необходим теплоноситель с самой лучшей текучестью и минимальной вязкостью
Первая помощь
При обнаружении пострадавшего с симптомами отравления этиленгликолем вызывайте бригаду скорой помощи. Времени на поход в поликлинику или вызов врача нет, нужна экстренная помощь, потому что интоксикация наступает моментально.
Доврачебная помощь:
- Обеспечьте больному свежий воздух, откройте окна или отведите на улицу.
- Давайте пить больше жидкости, чтобы увеличить диурез. Для питья подойдет теплый несладкий чай или обычная вода.
- Дайте сорбент (Полисорб, Активированный уголь), вызовите искусственную рвоту только если больной ведет себя адекватно и находится в сознании. Нарушается глотательный рефлекс, есть риск, что пострадавший захлебнется рвотными массами.
- Если пострадавший находится без сознания, освободите тело от сдавливающих элементов одежды (галстук) и положите больного на бок. При отсутствии сознания больше никаких реанимационных мероприятий до приезда скорой помощи не проводите.
- При попадании гликоля на слизистые оболочки (глаза) промойте пораженное место большим количеством воды.
До приезда бригады неотложной помощи постарайтесь выяснить у больного время приема токсической жидкости и объем принятого внутрь этиленгликоля. Сообщите врачам о наличии аллергии на медикаменты у пострадавшего.
Все остальные мероприятия делают медработники в условиях стационара.

Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колеблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.

Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией
Срок – не более пяти лет.
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.

Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхлоргидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Что такое этиленгликоль?
Этиленгликоль — это спирт, имеющий химическую формулу C2ЧАС6О2. Название этого соединения по ИЮПАК: этан-1,2-диол. При комнатной температуре и давлении это бесцветная жидкость без запаха, сладкая на вкус и вязкая. Эта жидкость умеренно токсична. Молярная масса этиленгликоля 62 г / моль. Температура плавления этой жидкости составляет -12,9 ° C, а температура кипения — 197,3 ° C. Этиленгликоль смешивается с водой, поскольку имеет группы -ОН, способные образовывать водородные связи.

Есть два способа производства этиленгликоля; производство в промышленных масштабах и биологический путь производства этиленгликоля. В промышленном масштабе этиленгликоль получают из этилена. Этилен превращается в оксид этилена, который затем превращается в этиленгликоль посредством реакции между оксидом этилена и водой. Эта реакция катализируется кислотами или основаниями. Если реакция проводится в среде с нейтральным pH, тогда реакционная смесь должна быть снабжена тепловой энергией. Биологический путь производства этиленгликоля заключается в разложении полиэтилена кишечными бактериями гусеницы восковой моли.
Разница между этиленгликолем и полиэтиленгликолем
Определение
Этиленгликоль: Этиленгликоль представляет собой бесцветное спиртовое соединение без запаха, имеющее химическую формулу C2ЧАС6О2.
Полиэтиленгликоль: Полиэтиленгликоль является полиэфирным соединением, что означает, что он имеет много эфирных групп.
Общая формула
Этиленгликоль: Общая формула для этиленгликоля является C2ЧАС6О2.
Полиэтиленгликоль: Общая формула для полиэтиленгликоля H- (O-CH2-СН2)N-ОН.
производство
Этиленгликоль: Этиленгликоль получают в результате реакции между этиленоксидом и водой.
Полиэтиленгликоль: Полиэтиленгликоль получают в результате реакции между этиленоксидом и водой, этиленгликолем или олигомерами этиленгликоля.
Молекулярный вес
Этиленгликоль: Молекулярная масса этиленгликоля составляет около 62,07 г / моль.
Полиэтиленгликоль: Молекулярная масса полиэтиленгликоля зависит от значения «n» в его общей формуле.
Пользы
Этиленгликоль: Этиленгликоль в основном используется для производства полиэфирных волокон и в качестве автомобильного антифриза.
Полиэтиленгликоль: Полиэтиленгликоль имеет множество применений, включая медицинские, химические, биологические, промышленные и т. Д.
Заключение
И этиленгликоль, и полиэтиленгликоль коммерчески очень важны и используются в ряде областей применения. Этиленгликоль представляет собой сиропообразную жидкость при комнатной температуре, тогда как полиэтиленгликоль представляет собой твердый материал. Основное различие между этиленгликолем и полиэтиленгликолем заключается в том, что этиленгликоль имеет фиксированное значение молекулярной массы, тогда как полиэтиленгликоль не имеет фиксированной величины молекулярной массы.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие транс-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята
Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
этан-1,2-диол
Растворимость (в г/100 г растворителя или характеристика):
1-бутанолЛит.аммиак жидкийЛит.анилинЛит.ацетонЛит.бензиловый спиртЛит.бензолЛит.водаЛит.гептанЛит.глицеринЛит.диэтиловый эфирЛит.изопропанолЛит.метанолЛит.тетрахлорметанЛит.уксусная кислотаЛит.формамидЛит.циклогексанонЛит.этанолЛит.
Реакции вещества:
- Количественно окисляется иодной кислотой до формальдегида.
- Окисляется перекисью водорода в присутствии сульфата железа(II) на холоду с образованием глиоксаля.
- Разлагается выше 500 С с образованием ацетальдегида, воды, метана, угарного газа, водорода.
- При реакции этиленгликоля с хлорным ангидридом в тетрахлорметане образуется этиленгликольдиперхлорат. Выход 60%.
HOCH2CH2OH + 2Cl2O7 → O3ClOCH2CH2OClO3 + 2HClO4 - Диэтилмалонат реагирует при нагревании с небольшим избытком этиленгликоля с образованием жидкого полиэтиленмалоната.
- Пероксид натрия способен воспламенять при контакте: метанол, этанол, пропанол, бутанол, изоамиловый спирт, бензиловый спирт, этиленгликоль, диэтиловый эфир, анилин, скипидар, уксусную кислоту.
Дополнительная информация::
Не дает азеотропов с водой, 2-аминоэтанолом, 2,3-дихлор-1-пропанолом, 1,3-дихлор-2-пропанолом, пропионамидом, этилкарбаматом, 1-хлор-2-пропанолом, глицерином, пирролом, этилхлорацетатом, тетрагидрофураном, 1,4-диоксаном, 1-бутанолом, фурфуролом, пиридином, 2-метоксиэтилацетатом, диэтилкарбонатом, 3-метил-1-бутанолом, 2-пропоксиэтанолом, 2-хлорфенолом, 4-хлорфенолом, бензолом, фенолом, пирокатехином, 2-пиколином, 3-пиколином, 1,2-фенилендиамином.
Источники информации:
- CRC Handbook of Chemistry and Physics. — 90ed. — CRC Press, 2010. — С. 5-22
- Flick E.W. Industrial solvent handbook. — 5ed. — 1998. — С. 359-367
- Seidell A. Solubilities of organic compounds. — 3ed., vol.2. — New York: D. Van Nostrand Company, 1941. — С. 156-158
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. — М.-Л.: Химия, 1964. — С. 124
- Волков А.И., Жарский И.М. Большой химический справочник. — Минск: Современная школа, 2005. — С. 386 (плотность растворов)
- Дымент О.Н., Казанский К.С., Мирошников А.М. Гликоли и другие производные окисей этилена и пропилена. — М.: Химия, 1976
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. — 2 изд, Ч.2. — М.: Ассоциация Пожнаука, 2004. — С. 717
- Краткая химическая энциклопедия. — Т. 5: Т-Я. — М.: Советская энциклопедия, 1967. — С. 1033-1034
- Мономеры для поликонденсации. — М.: Мир, 1976. — С. 232
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 198
- Справочник по растворимости. — Т.1, Кн.2. — М.-Л.: ИАН СССР, 1962. — С. 1262-1263
- Справочник по химии. Для учащихся средней школы. — М.: Просвещение, 1970. — С. 158
- Справочник химика. — 2 изд., Т.1. — Л.-М.: Химия, 1966. — С. 1057 (температуры замерзания растворов)
- Хёрд Ч.Д. Пиролиз соединений углерода. — Л.-М.: ГОНТИ РКТП СССР, 1938. — С. 163
- Химическая энциклопедия. — Т. 5. — М.: Советская энциклопедия, 1999. — С. 496-497
- Химический энциклопедический словарь. — Под ред. Кнунянц И.Л. — М.: Советсткая энциклопедия, 1983. — С. 718
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
этан-1,2-диол
Реакции вещества:
- Количественно окисляется иодной кислотой до формальдегида.
- Окисляется перекисью водорода в присутствии сульфата железа(II) на холоду с образованием глиоксаля.
Дополнительная информация:
Не дает азеотропов с водой, 2-аминоэтанолом, 2,3-дихлор-1-пропанолом, 1,3-дихлор-2-пропанолом, пропионамидом, этилкарбаматом, 1-хлор-2-пропанолом, глицерином, пирролом, этилхлорацетатом, тетрагидрофураном, 1,4-диоксаном, 1-бутанолом, фурфуролом, пиридином, 2-метоксиэтилацетатом, диэтилкарбонатом, 3-метил-1-бутанолом, 2-пропоксиэтанолом, 2-хлорфенолом, 4-хлорфенолом, бензолом, фенолом, пирокатехином, 2-пиколином, 3-пиколином, 1,2-фенилендиамином.
Источники информации:
- CRC Handbook of Chemistry and Physics. — 90ed. — CRC Press, 2010. — С. 5-22
- Flick E.W. Industrial solvent handbook. — 5ed. — 1998. — С. 359-367
- Seidell A. Solubilities of organic compounds. — 3ed., vol.2. — New York: D. Van Nostrand Company, 1941. — С. 156-158
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. — М.-Л.: Химия, 1964. — С. 124
- Волков А.И., Жарский И.М. Большой химический справочник. — Минск: Современная школа, 2005. — С. 386 (плотность растворов)
- Дымент О.Н., Казанский К.С., Мирошников А.М. Гликоли и другие производные окисей этилена и пропилена. — М.: Химия, 1976
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. — 2 изд, Ч.2. — М.: Ассоциация Пожнаука, 2004. — С. 717
- Краткая химическая энциклопедия. — Т. 5: Т-Я. — М.: Советская энциклопедия, 1967. — С. 1033-1034
- Мономеры для поликонденсации. — М.: Мир, 1976. — С. 232
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 198
- Справочник по растворимости. — Т.1, Кн.2. — М.-Л.: ИАН СССР, 1962. — С. 1262-1263
- Справочник по химии. Для учащихся средней школы. — М.: Просвещение, 1970. — С. 158
- Справочник химика. — 2 изд., Т.1. — Л.-М.: Химия, 1966. — С. 1057 (температуры замерзания растворов)
- Хёрд Ч.Д. Пиролиз соединений углерода. — Л.-М.: ГОНТИ РКТП СССР, 1938. — С. 163
- Химическая энциклопедия. — Т.5. — М.: Советская энциклопедия, 1999. — С. 496-497
- Химический энциклопедический словарь. — Под ред. Кнунянц И.Л. — М.: Советсткая энциклопедия, 1983. — С. 718
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).