Уравнение реакции этиленгликоля с водородом
Содержание:
- Симптомы отравления
- Этиленгликоль — Часто задаваемые вопросы
- Свойства продукта и технические характеристики
- ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
- Физико-химические свойства этиленгликоля
- Слайды и текст этой презентации
- Характеристика пропиленгликоля и глицерина
- Клинические данные
- Применение этанола
- Области применения и ценовая политика продукционного ряда
- Применение [ править | править код ]
Симптомы отравления
При употреблении этиленгликоля внутрь, сначала развивается состояние, напоминающее алкогольное опьянение. Уже через 1 час начинают проявляться симптомы поражения центральной нервной системы. Состояние больного стремительно ухудшается.
Попадая в организм, этиленгликоль превращается в токсические соединения (гликоль альдегид, щавелевую кислоту и т. д). У больного нарастает ацидоз – окисление крови, и запускается ряд каскадных реакций, при которых происходит поражение практически всех внутренних структур организма.
Клиническое течение отравления этиленгликолем условно разделяют на несколько периодов:
- Первый период длится в среднем до 14 часов. В случае тяжелой интоксикации смерть может наступить на протяжении первых нескольких часов. Симптомы периода:
- выраженное алкогольное опьянение, повышенная возбужденность;
- тошнота и многократная рвота, при которой рвотные массы могут содержать не только остатки выпитого химиката, но и желудочный сок, желчь;
- боль во всем животе, носящая острый характер, напоминающая спазмы;
- расстройство стула, понос;
- головная боль, головокружение;
- нарушение сознания и появление судорог;
- возможен летальный исход вследствие отека головного мозга и остановки дыхания.
- Второй период длится 2-3 суток. У выживших больных наблюдаются тяжелые нарушения в работе большинства органов и систем:
- нарушение ритма сердца;
- падение артериального давления;
- отек легких проявляется одышкой, кашлем, нехваткой воздуха;
- острая сердечная недостаточность;
- токсический гепатит;
- острая почечная недостаточность.
- Третий период проявляется тяжелой почечной и печеночной недостаточностью. Больные, не получившие необходимой медицинской помощи, как правило, не доживают до этого срока.
Этиленгликоль — Часто задаваемые вопросы
- Можно ли смешивать этиленгликоль с пропиленгликолем?
Ответ на этот вопрос ищет каждый автовладелец, который интересуется, можно ли смешивать охлаждающие жидкости на основе разных гликолей. Не следует этого делать. В случае этиленгликоля и пропиленгликоля основное различие заключается в плотности этих веществ. На практике трудно измерить стойкость жидкости к замерзанию, и это может привести к проблемам в зимнее время года.
- Как отличить этиленгликоль от пропиленгликоля?
Существует метод различения этих двух гликолей, при котором выявляются различия физических свойств, удельной плотности и показателя преломления между этиленгликолем и пропиленгликолем. Показатель преломления является очень полезным параметром для определения того, с каким соединением мы имеем дело. Несколько капель вещества помещают на призму специального прибора, так называемого рефрактометра, и считывают показатель преломления для идентификации.
- Чем этиленгликоль отличается от глицерина?
Оба соединения относятся к одной химической группе, т. е. к спиртам. Они отличаются количеством гидроксильных групп -ОН в молекуле. Глицерин является производным пропана (пропантриола), а этиленгликоль — производным этана (этандиола). В водных растворах они понижают температуру замерзания, а также повышают температуру кипения. При выборе между глицерином и этиленгликолем стоит остановиться на первом, так как он более безопасен в использовании. Более того, он также оказывает меньшее негативное воздействие на окружающую среду.
- Где можно приобрести этиленгликоль?
Этиленгликоль можно купить в химических магазинах или у оптовиков. Цена данного вещества сильно колеблется. Стоит отдать предпочтение продукту наивысшего качества. В ассортимент реагентов Группы PCC также входит этиленгликоль (номер CAS 9005-07-6).
- Какими могут быть симптомы отравления этиленгликолем?
Отравление этиленгликолем очень часто напоминает состояние алкогольного опьянения. Отмечается заметная бессвязность движений, сонливость, учащенное дыхание, повышение артериального давления и, в некоторых случаях, судороги. Нельзя преуменьшать опасность отравления этиленгликолем. Через 24 часа появляются первые симптомы почечной недостаточности. Отравление вызывает нарушение кровообращения и даже глубокое поражение центральной нервной системы.
- Как отличить этиленгликоль от глюкозы?
Различить эти два соединения можно при помощи популярной реакции Троммера. Глюкоза относится к так называемым альдозам, которые, в свою очередь, классифицируются как альдегиды. Известно, что альдегиды поддаются пробе Троммера, в отличие от диолов (например, этиленгликоля), которые не поддаются. Весь эксперимент основан на редукции (испытуемым веществом) синего гидроксида меди (II) CuOH2 до кирпично-красного оксида меди (I) Cu2O в щелочной среде.
Свойства продукта и технические характеристики
Этиленгликоль представляет собой бесцветную вязкую гигроскопичную жидкость без запаха, сладковатого вкуса. Температура кипения 197,6 °С, температура плавления –12,7 °С, плотность – 1,1132 г/см3. Хорошо растворим в воде, спиртах, кетонах и др., умеренно — в бензоле, толуоле, диэтиловом эфире. Водные растворы этиленгликоля замерзают при низких температурах (до -70 °С).
Этиленгликоль ядовит. При попадании внутрь действует на центральную нервную систему и почки, смертельная доза — 1,4 г/кг. Предельно допустимая концентрация в воздухе рабочей зоны — 5 мг/м3. Относится к третьему классу опасности. Из-за низкой упругости паров этиленгликоль не вызывает острых отравлений при вдыхании.
При транспортировке этиленгликоль должен быть расфасован только в алюминиевые бочки или бочки из коррозионно-стойкой стали. Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а также в железнодорожных цистернах. Хранят в бочках в закрытых не отапливаемых складах.
В нижеследующей таблице кратко представлены технические требования к моноэтиленгликолю высшего и первого сорта согласно ГОСТ 19710-83.
Технические характеристики этиленгликоля (согласно ГОСТ 19710-83)
|
Показатель |
Значение |
|
|
Высший Сорт |
Сорт 1 |
|
|
Массовая доля этиленгликоля. %. не менее |
99,8 |
98,5 |
|
Массовая доля диэтиленгликоля. %. не более |
0,05 |
1,0 |
|
Цвет в единицах Хазена, не более: в обычном состоянии |
5 |
20 |
|
после кипячения с соляной кислотой |
20 |
— |
|
Массовая доля остатка после прокаливания, %, не более |
0,001 |
0,002 |
|
Массовая доля железа. %. не более |
0,00001 |
0,0005 |
|
Массовая доля воды, %, не более |
0,1 |
0,5 |
|
Массовая доля кислот в пересчете на уксусную, %, не более |
0,0006 |
0,005 |
|
Показатель преломления при 20° С |
1,431-1,432 |
1,430-1,432 |
|
Пропускание в ультрафиолетовой области спектра,%, не менее, при длинах волн, нм: 220 |
75 |
— |
|
275 |
95 |
— |
|
350 |
100 |
— |
Этиленгликоль был впервые получен в 1859 году французским химиком Шарлем Адольфом Вудсом. Первое промышленное производство этиленгликоля основывалось на гидролизе дихлорэтана водным раствором соды при 200 °С и давлении 10 МПа. Он использовался в небольших масштабах в период Первой мировой войны в качестве теплоносителя и компонента взрывчатых веществ. Широкое промышленное производство началось в 1937 году, когда был разработан процесс прямого окисления этилена в этиленоксид, что обеспечило доступным сырьем производство этиленгликоля. В настоящее время мировое производство этиленгликоля основано на гидратации окиси этилена.
В период Второй мировой войны этиленгликоль получил широкое распространение в авиации, где он стал использоваться в качестве охладителя радиатора и антиобледенителя стекол. В последующие годы сферы использования этиленгликоля расширялись, появлялись новые продукты на его основе
На сегодняшний день производство этиленгликоля является важной составляющей химической промышленности. Потребность в этом продукте в мире с каждым годом увеличивается
Промышленные методы производства этиленгликоля
В настоящее время основным промышленным способом получения этиленгликоля является гидратации окиси этилена. Реакция включает раскрытие эпоксидного цикла и образование гидроксильных групп. Она проходит в воде при небольшом нагревании и несколько повышенном давлении в присутствии кислотного катализатора.
Процесс проводят в нейтральной среде под давлением 10≈12 кгс/см2 при 160≈180 °С в непрерывно действующем автоклаве, который представляет собой стальную колонну высотой 10 м и диаметром 1 м. Раствор, выходящий из автоклава, упаривают в двух- или трехкорпусном выпарном агрегате и фракционируют. В процессе производства моноэтиленгликоля получаются также ди- и триэтиленгликоли.
С установки выходит достаточно чистый этиленгликоль, который удовлетворяет жестким требованиям, предъявляемым производителями полиэтилентерефталата и полиэфирных волокон. Ниже представлена схема установки по получению этиленгликоля и ориентировочный материальный баланс процесса.

ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Екатеринбург 2016
— Понятие об Спиртах
— Применение спиртов в промышленности
Введение
СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Многоатомные спирты
Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Этиленгликоль
Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают путём:
· (I) гидратацией 1,2-дихлорэтана;
· (II) гидратацией хлоргидринов;
· (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
· (IV) окислением этилена перманганатом калия:

ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие с щелочными металлами: образует соли гликоляты

основаниями. Качественным реактивом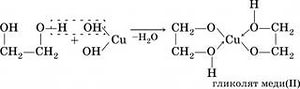
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину)
3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O

4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться
· глиоксалевая и щавелевая кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
Трехатомный спирт,входящий в состав сложных эфиров природного происхождения — жидких и твердых жиров.
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
Физико-химические свойства этиленгликоля
Этиленгликоль с формулой CH2OH2, также известный как 1,2-этандиол, является популярным органическим соединением. Паспорт безопасности этиленгликоля, а также других веществ является основным источником информации об их физических и химических свойствах. Этиленгликоль — основной компонент антифризов в ОВиК и автомобильных системах. Формула гликоля четко указывает на его принадлежность к химической группе дигидроксиспиртов, также известных как диолы. Таким образом, гликоль в виде спирта представляет собой бесцветную жидкость с высокой вязкостью и сладким вкусом. Помимо отличной смешиваемости с водой, он также хорошо растворяется в альдегидах, кетонах и уксусной кислоте, но совсем не растворяется в четыреххлористом углероде. Относительно дешевый в производстве. К его недостаткам можно отнести кристаллизацию при низких температурах и более низкую (по сравнению с пропиленгликолем) теплоемкость (около 50% от теплоемкости воды).
Этиленгликоль имеет высокую температуру кипения (197°C) при низкой молекулярной массе. Это связано с сильной ассоциацией молекул в жидкой фазе, вызванной образованием водородных связей. В чистом виде этиленгликоль замерзает примерно при температуре -13°С, но смесь этиленгликоль: вода может оставаться жидкой при гораздо более низких температурах. Например, смесь 40% воды и 60% гликоля может выдерживать температуры до -37°C. Следует отметить, что этиленгликоль смешивается с водой в неограниченной пропорции. Это связано с наличием в структуре двух гидроксильных групп.
Изучая справочные материалы или предложения производителей, вы можете встретить термин моноэтиленгликоль, сокращенно МЭГ. Однако стоит иметь в виду, что моноэтиленгликоль и этиленгликоль — это одно и то же вещество.
Слайды и текст этой презентации

РАБОТУ ВЫПОЛНИЛИ УЧЕНИЦЫ 10 КЛАССА САФРОНОВА ДИАНА И ЛАЗАРЕНКО ВИКТОРИЯ.
ЭТИЛЕНГЛИКОЛЬ

ВВЕДЕНИЕ
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), — двухатомный спирт, простейший представитель многоатомных спиртов. Хим. формула: C2H6O2 или C2H4(OH)2Структурная формула: HO—CH2—CH2—OH

ФИЗИЧЕСКИЕ СВОЙСТВА
Бесцветная вязкая жидкость без запаха, сладковатого вкуса; Хорошо растворяется в воде и в этаноле;Температура плавления -12,7 °С;Температура кипения 197,6 °С;Этиленгликоль токсичен при попадании внутрь, действует на центральную нервную систему и почки;

ХИМИЧЕСКИЕ СВОЙСТВА

ХИМИЧЕСКИЕ СВОЙСТВА

ПОЛУЧЕНИЕ
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.

ИСТОРИЯ ОТКРЫТИЙ И ПРОИЗВОДСТВА
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида.
Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми производителями динамита.

ПРИМЕНЕНИЕ
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −49 °С.
В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
Как растворитель красящих веществ;
В органическом синтезе: в качестве высокотемпературного растворителя.

Этиленгликоль также применяется:при производстве конденсаторовпри производстве 1,4-диоксанакак теплоноситель в системах чиллер-фанкойл (Водоохлаждающая машина — аппарат для охлаждения жидкости)в качестве компонента крема для обуви (1—2 %)в составе для мытья стёкол вместе с изопропиловым спиртом

МЕРЫ БЕЗОПАСНОСТИ
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему).Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.Летальная доза при однократном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
Характеристика пропиленгликоля и глицерина
Пропиленгликоль (С3Н8О2) — это бесцветная жидкость. Его структурные характеристики таковы, что он является немного вязким, имеет слабый характерный запах и сладковатый вкус. Обладает гигроскопическими свойствами. В качестве добавки Е1520 пропиленгликоль разрешён в большинстве стран мира. Он считается нетоксичным веществом. При попадании на кожу или внутрь организма не вызывает раздражения и отравления. Удаляется при помощи воды.
У него можно выделить несколько основных физических свойств. К ним относятся:

- температура замерзания при -59;
- сохранение вкуса;
- удержание влаги;
- растворимость в воде;
- нетоксичность;
- антикоррозионность.
Способы получения
Основным способом получения пропиленгликоля или пропандиола является каталитическая гидратация окиси пропилена. Это осуществляется при температуре 150−220 градусов по Цельсию. У пропиленгликоля довольно широкий спектр применения, и его используют для производства следующих продуктов и веществ:

- антифризы;
- пищевые красители;
- крема и мази;
- пищевые ароматизаторы;
- жидкость для электронных сигарет.
Основными производителями в Европе являются компании Basf chemical и DWO Europe GMBH. Это вещество продаётся в основном под этими марками.
Свойства и использование глицерола
Глицерин — простейший представитель трёхатомных спиртов. Представляет собой вязкую бесцветную жидкость. Смешивается с водой в любых пропорциях. Если сравнить физические свойства основ, то даже без специальных исследований заметно, что этиленгликоль и пропиленгликоль во многом похожи, в отличие от глицерина. Последний даже при плюсовых температурах остаётся достаточно вязким.

Глицерин является довольно безвредным веществом. Он гигроскопичен, т. е. способен удерживать влагу, поглощая её, например, из воздуха. На этом свойстве основано его применение в косметической промышленности, где он используется для производства средств, увлажняющих кожу. Его также можно приобрести в аптеке, где он выпускается в качестве слабительных свечей или в жидком виде. Кроме того, глицерин используется в сельском хозяйстве для обработки семян и сеянцев деревьев. Это помогает прорастанию злаков и защищает кору деревьев от непогоды.
Клинические данные
- Интоксикация первые 3-4 часа (как с этанолом) часто со снижением сознания, тошнотой, рвотой и атаксией.
- Ацидоз из-за гликозиловой кислоты через 3-4 часа.
- Гипервентиляция, тахикардия и гипертония.
- Тяжелый ацидоз может вызвать гипотензию, кому и остановку дыхания.
- Судороги, возможно, отек диска зрительного нерва.
- Острая олигурическая почечная недостаточность.
Дополнительные исследования
· Определение уровня глюкозы поможет исключить или подтвердить гипогликемию.
· Анализ крови укажет на тиленгликоль в плазме.
· Разрыв осмоляльности (расчет разрыва осмоляльности) увеличивается при отравлении.
· Расчет электролитов и анионного зазора (расчет анионного зазора) увеличивается.
· Кислотное / основное состояние и газы крови: метаболический ацидоз, ионизированный кальций, гипокальциемия, креатинин.
· Микроскопия анализа крови укажет на кристаллы (может пройти некоторое время, прежде чем они сформируются). Кристаллы бывают 2 типов: игольчатый (оксалат кальция) и конверт формы.
Пациент с подозрением на отравление этиленгликолем должен быть немедленно госпитализирован и обследован.
Применение этанола
Богатый спектр воздействия винного спирта позволяет применять его в различных сферах. Самое широкое распространение он получил в следующих областях:
В качестве автомобильного топлива
Применение этанола как моторного топлива связано с именем американского промышленника Генри Форда. В 1880 году он изобрел первый автомобиль, работающий на этиловом спирте. Впоследствии это вещество начали применять для работы ракетных двигателей, разнообразных нагревательных приборов, грелок для туристов и военнослужащих.
Сейчас также активно используется бензин Е85 и Е95 на основе биоэтанола, что способствует уменьшению потребления нефтепродуктов, выброса парниковых газов и применения ископаемого топлива.
Таким образом, благодаря использованию автомобильного топлива с полным сгоранием (биоэтанол и его смеси) улучшается экологическая ситуация, поскольку воздух мегаполисов загрязняют преимущественно транспортные выхлопы.
В состав продуктов сгорания бензина входит огромное количество веществ, представляющих опасность для здоровья.
Фармакологическое производство
В этой отрасли этанол используется по-разному. Дезинфицирующие свойства медицинского спирта допускают его применение для обработки операционного поля, рук врача-хирурга. Благодаря использованию этанола удается уменьшить проявления лихорадки, изготавливать основы для настоек и компрессы.
Винный спирт принадлежит к противоядиям, помогающим при интоксикации этиленгликолем и метанолом. Он также применяется как пеногаситель при подаче кислорода либо искусственной вентиляции легких.

Химическая отрасль
Используя этанол, получают другие вещества, к примеру, этилен. Поскольку винный спирт является превосходным растворителем, он получил применение в производстве лакокрасочной продукции, средств бытовой химии.
Пищевая индустрия
Этанол служит основным компонентом алкогольных напитков. Он входит в состав продуктов, полученных посредством процессов брожения. Этиловый спирт применяют в качестве растворителя всевозможных ароматизаторов и консерванта при производстве хлебобулочных и кондитерских изделий. Он также служит пищевой добавкой Е1510.
Косметическая промышленность
Производители косметических и парфюмерных средств используют этанол для изготовления туалетной воды, духов, шампуней, одеколонов, спреев и другой продукции.
Иные направления
Этиловый спирт применяется для работы с препаратами, имеющими биологическую природу.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колеблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.

Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией
Срок – не более пяти лет.
Применение [ править | править код ]
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона

1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.