Изопроцессы, работа в термодинамике, первый закон термодинамики
Содержание:
- Определение в термодинамике
- Внутренний холод
- 4. Единицы и шкала измерения температуры
- Специфика разных дисциплин
- Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
- Теория и практика
- Распределение энергии по степеням свободы
- ООО Свой Мастер & PoliStyle
- Вступление
Определение в термодинамике
В термодинамике температура определяется из полной энергии системы (называемой в этом контексте внутренней энергией ) и количества состояний, которые она может иметь при фиксированном значении этой энергии, которое задается понятием энтропии . Затем мы говорим о термодинамической температуре , которая измеряется в Кельвинах и минимум которой равен абсолютному нулю , что на практике недостижимо из-за квантовых свойств . 450 p K ( т.е. 0,45 n K или 0,000 000 000 45 K ), то есть -273,149 999 999 55 ° C , — это рекорд, достигнутый в 2003 году в исследовательской лаборатории Массачусетского технологического института (MIT) группой под руководством лауреата Нобелевской премии по физике Вольфганга Кеттерле .
В некоторых физических экспериментах расчет температуры посредством ее может в исключительных случаях приводить к отрицательным значениям. Эти отрицательные значения чрезвычайно низки (от нескольких пикокельвинов до нескольких нанокельвинов). Они появляются при измерении некоторых очень специфических квантовых систем, энтропия которых после достижения максимума начинает уменьшаться по мере добавления к ним дополнительной энергии. Таким образом, знак минус появляется только потому, что направление вариации, используемой в формуле, в конечном итоге было изменено на противоположное. Образцы, для которых измеряются такие отрицательные абсолютные температуры , не «холоднее» абсолютного нуля, поскольку они будут обеспечивать теплом любую другую систему, которая вступает с ними в контакт. Отрицательные абсолютные температуры также не означают, что температура в какой-то момент прошла через абсолютный ноль, «последний остается недостижимым».
Внутренний холод
Температуры очень низкие удавалось получать в лабораториях, где физики пытались приблизиться к абсолютному нолю хотя бы на короткие промежутки времени. И они смогли подойти к нему очень близко — ближе, чем в открытом космосе.
В лабораториях используются в качестве охладителей многие жидкие газы, однако и они теплее абсолютного ноля. Можно охладить азот до жидкого состояния — этот газ переходит в него при 77 градусах Кельвина (-196 Цельсия). Жидкий азот легко транспортируется в особых емкостях и используется в больницах для хранения биологических образцов, в том числе для замораживания эмбрионов и спермы в клиниках для больных бесплодием; находит он применение и в современной электронике. Если капнуть жидким азотом на цветок гвоздики, он станет до того хрупким, что уроните его на пол — и он разобьется, точно фарфоровый.
Еще холоднее жидкий гелий — всего 4 градуса Кельвина, однако и эта температура изрядно выше абсолютного ноля. А вот при смешивании двух типов гелия — гелия-3 и гелия-4 — достигается температура в несколько тысячных градуса Кельвина.
Для достижения температур еще более низких физикам приходится использовать изощренные методы. В 1994-м ученые Американского национального института стандартов и технологии (NIST), находящегося в Боулдере, штат Колорадо, с помощью лазера охладили атомы цезия до 700 миллиардных градуса Кельвина. Девять лет спустя ученым Массачусетского технологического института удалось пойти дальше, достигнув 0,5 миллиардных градуса Кельвина.
На самом-то деле абсолютный ноль — идея абстрактная. Такую температуру никогда не удавалось получить в лаборатории или измерить в природе. Ученым, подбирающимся к ней все ближе, приходится мириться с тем, что достигнуть ее никогда не удастся. Но почему? Во-первых, любой термометр, сам не имеющий температуру абсолютного ноля, будет отдавать тепло и тем самым сорвет опыт. Во-вторых, измерять температуру при столь низких энергиях вообще затруднительно — начинают работать такие эффекты, как сверхпроводимость, вмешивается квантовая механика, а это воздействует на движение и состояние атомов. Так что мы просто не сможем узнать наверняка, что уже добрались до абсолютного ноля. Абсолютный ноль — это тот самый случай, когда «нет там никакого там».
4. Единицы и шкала измерения температуры
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (то есть в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
4.1. Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что равно −273.15 °C (точно).
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Важное значение имеет разработка на основе термодинамической шкалы Кельвина Международных практических шкал, основанных на реперных точках — фазовых переходах чистых веществ, определенных методами первичной термометрии. Первой международной температурной шкалой являлась принятая в 1927 г
МТШ-27. С 1927 г. шкала несколько раз переопределялась (МТШ-48, МПТШ-68, МТШ-90): менялись реперные температуры, методы интерполяции, но принцип остался тот же — основой шкалы является набор фазовых переходов чистых веществ с определенными значениями термодинамических температур и интерполяционные приборы, градуированные в этих точках. В настоящее время действует шкала МТШ-90. Основной документ (Положение о шкале) устанавливает определение Кельвина, значения температур фазовых переходов (реперных точек) и методы интерполяции.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что цена одного деления по шкале Кельвина равна цене деления шкалы Цельсия, а цена деления шкалы Ранкина эквивалентна цене деления термометров со шкалой Фаренгейта. Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K, 0 °C, 32 °F.
Масштаб шкалы Кельвина привязан к тройной точке воды (273,16 К), при этом от неё зависит постоянная Больцмана. Это создаёт проблемы с точностью интерпретации измерений высоких температур. Сейчас МБМВ рассматривает возможность перехода к новому определению кельвина и фиксированию постоянной Больцмана, вместо привязки к температуре тройной точки..
4.2. Шкала Цельсия
В технике, медицине, метеорологии и в быту используется шкала Цельсия, в которой температура тройной точки воды равна 0,008 °C, и, следовательно, точка замерзания воды при давлении в 1 атм равна 0 °C. В настоящее время шкалу Цельсия определяют через шкалу Кельвина: цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина, t(°С) = Т(К) — 273,15. Таким образом, точка кипения воды, изначально выбранная Цельсием, как реперная точка, равная 100 °C, утратила свое значение, и по современным оценкам температура кипения воды при нормальном атмосферном давлении составляет около 99,975 °C.Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
4.3. Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 9/5 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724.
Специфика разных дисциплин
Метеорология
В области метеорологии температуру атмосферы часто пишут T °. Приблизившись к земле, его берут под укрытие на высоте двух метров над землей. Мы говорим о температуре ветра , чтобы выразить температуру, ощущаемую под воздействием ветра, также известную как субъективная температура, ощущение жара или холода или даже температура ветра (подробнее см. Холодный ветер ).
В температурах сухих соответствуют классической температуре , заданной термометр защищено от влажности и радиации. На диаграмме влажного воздуха кривая постоянной температуры представляет собой вертикальную линию.
Температура влажного термометра или температура влажного термометра измеряется термометром, на котором вода испаряется. Обычно используется влажная пена, которая вентилируется. Температура влажного воздуха всегда ниже температуры сухого; они тем более равны, что относительная влажность близка к 100%. Прибор, используемый для одновременного измерения температуры в сухой и влажной среде, — это .
Биология и медицина
-
Гомеотермные , пойкилотермные животные
- Температура тела
Когда дело доходит до качества воздуха в помещении и здоровья людей, очень важно правильно регулировать температуру. Действительно, слишком высокий он способствует развитию пылевых клещей и плесени
При правильном регулировании это позволяет значительно сэкономить энергию и косвенную финансовую экономию.
Физический
Существует множество определений температуры, поскольку рассматриваемый объект не находится в тепловом равновесии. По характерным названиям мы идентифицируем различные температуры, сигнализирующие о внезапном изменении свойств тела. Смотрите Температура (значения) для более подробной информации.
Социопсихология
В зависимости от культуры тепло окружающей среды, среды обитания, одежды, предметов или еды вызывает разные вещи и способствует разному социальному поведению
Слова «теплый» или «холодный» или такие фразы, как «холодные руки, согревают сердце», показывают основную важность тепла в человеческих взаимодействиях.. Эксперименты показали, что субъект, держащий чашку горячего кофе, обычно находит окружающих более теплыми и заботливыми, чем если бы он держал холодный кофе
Он с большей готовностью предложит подарок окружающим после горячего кофе, в то время как он будет стараться позаботиться о себе после того, как выпил холодный кофе.
Эксперименты показали, что субъект, держащий чашку горячего кофе, обычно находит окружающих более теплыми и заботливыми, чем если бы он держал холодный кофе. Он с большей готовностью предложит подарок окружающим после горячего кофе, в то время как он будет стараться позаботиться о себе после того, как выпил холодный кофе.
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Просмотров: 858
Температура — это просто!
Температура
Температура — это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах — это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
— используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
— точность измерения от 0,003oС до 0,02oС
— интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях. Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
— введена английским физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: = 1K (Кельвин)
Нулевая температура абсолютной шкалы — это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа — основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.Заметьте, здесь концентрация молекул также одинакова!
Следующая страница «Идеальный газ. Основное уравнение МКТ»
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся.
Вот он, еще один отличный день для практических занятий по физике. Сегодня, дорогие друзья, мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая потоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них
Изотермический – протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный – протекает при поcтоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный – идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Теория и практика
Абсолютный нуль температуры – понятие теоретическое, достичь его на практике невозможно в принципе, даже в условиях научных лабораторий с самой сложной аппаратурой. Но ученым удается охлаждать вещество до очень низких температур, которые близки к абсолютному нулю.
При таких температурах вещества приобретают удивительные свойства, которых они не могут иметь при обычных обстоятельствах. Ртуть, которую называют «живым серебром» из-за ее пребывания в состоянии, близком к жидкому, при такой температуре становится твердой – до такой степени, что ею можно забивать гвозди. Некоторые металлы становятся хрупкими, как стекло. Такой же твердой и хрупкой становится резина. Если при температуре, близкой к абсолютному нулю, ударить молотком какой-нибудь резиновый предмет, он разобьется, как стеклянный.
Такое изменение свойств тоже связано с природой теплоты. Чем выше температура физического тела, тем интенсивнее и хаотичнее двигаются молекулы. По мере снижения температуры движение становится менее интенсивным, а структура – более упорядоченной. Так газ становится жидкостью, а жидкость твердым телом. Предельный уровень упорядоченности – кристаллическая структура. При сверхнизких температурах ее приобретают даже такие вещества, которые в обычном состоянии остаются аморфными, например, резина.
Интересные явления происходят и с металлами. Атомы кристаллической решетки колеблются с меньше амплитудой, рассеяние электронов уменьшается, поэтому падает электрическое сопротивление. Металл приобретает сверхпроводимость, практическое применение которой представляется весьма заманчивым, хотя и труднодостижимым.
Тело
– это одно из основных понятий в физике, под которым подразумевается форма существования материи или вещества. Это материальный объект, который характеризуется объемом и массой, иногда также другими параметрами. Физическое тело явно отделено от других тел границей. Существует несколько особенных видов физических тел, не следует понимать их перечисление как классификацию.
В механике под физическим телом чаще всего понимается материальная точка. Это некая абстракция, главным свойством которой является факт того, что реальными размерами тела для решения конкретной задачи можно пренебречь. Иными словами, материальная точка – это вполне конкретное физическое тело, которое имеет размеры, форму и прочие подобные характеристики, но они совершенно не важны для того, чтобы решить имеющуюся задачу. К примеру, если нужно посчитать среднюю скорость объекта на определенном участке пути, с его длиной при решении задачи можно совершенно не считаться. Еще один тип физических тел, рассматриваемый механикой – это абсолютно твердое тело. Механика такого тела точно такая же, как и механика материальной точки, но дополнительно обладает и другими свойствами. Абсолютно твердое тело состоит из материальных точек, но ни расстояние между ними, ни распределение массы не меняются под нагрузками, которым подвергается тело. Это означает, что оно не может быть деформировано. Чтобы определить положение абсолютно твердого тела, достаточно задать привязанную к нему систему координат, обычно декартову. В большинстве случаев центр массы является также и центром системы координат. В природе абсолютно твердого тела не существует, но для решения многих задач такая абстракция очень удобна, хотя в релятивистской механике она не рассматривается, так как при движениях, скорость которых сравнима со скоростью света, эта модель демонстрирует внутренние противоречия. Противоположностью абсолютно твердому телу является деформируемое тело, частицы которого могут смещаться друг относительно друга. Существуют особенные типы физических тел и в других отраслях физики. Например, в термодинамике введено понятие абсолютно черного тела. Это идеальная модель, такое физическое тело, которое поглощает абсолютно все электромагнитное излучение, попадающее на него. При этом, само оно вполне может продуцировать электромагнитное излучение и иметь любой цвет. Пример объекта, который наиболее приближен по свойствам к абсолютно черному телу – это Солнце. Если взять вещества, распространенные за Земле, то можно вспомнить о саже, которая поглощает 99% излучения, попадающего на нее, кроме инфракрасного, с поглощением которого это вещество справляется гораздо хуже.
Видео по теме
Ливанова А. Низкие температуры, абсолютный нуль и квантовая механика
Распределение энергии по степеням свободы
Выражение
для средней энергии молекулы газа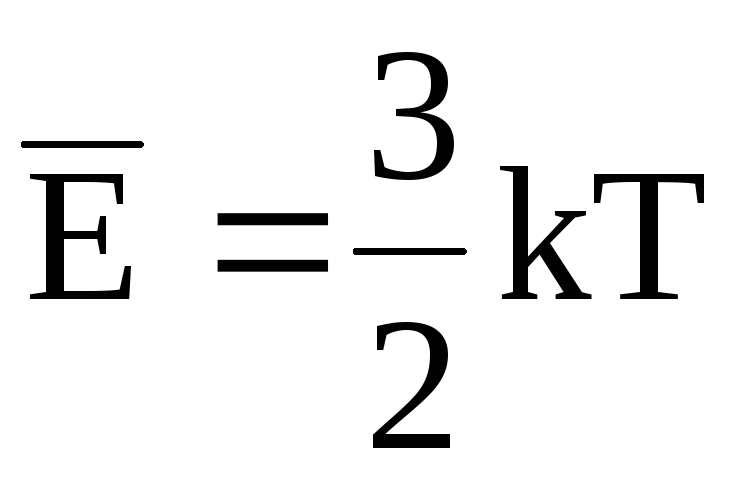 учитывает только её среднюю энергию
учитывает только её среднюю энергию
поступательного движения. Но наряду с
поступательным движением, молекула
может вращаться и совершать колебания.
Эти виды движения так же связаны с
некоторым запасом энергии, определить
который, можно пользуясь понятием
статистической физики о равном
распределении энергии по степеням
свободы.
Число
независимых координат, необходимых для
полного описания положения системы в
пространстве, называется
числом степеней свободы
(i).
Так,
например, движение точки, совершающей
перемещение по всей области пространства
в любой момент времени будет полностью
описано тремя координатами, т. е. она
обладает тремя степенями свободы (i=3).
Если на характер
изучаемого движения накладывать
некоторые ограничения, то число степеней
свободы уменьшается.
Так
для описания движения точки по поверхности
необходимо задать две независимые
координаты, т.е. движущаяся по поверхности
точка имеет две степени свободы (i
= 2).
Точка,
совершающая движение по прямой, имеет
одну степень свободы (i
= 1). В общем
случае точка или система точек наряду
с поступательным движением может
одновременно участвовать во вращательном
и колебательном движениях. Общее число
степеней свободы в этом случае будет
равно
 (12.1)
(12.1)
где
iп
— число степеней свободы поступательного
движения точки;
iвр
— число степеней свободы вращательного
движения точки;
iк
— число степеней свободы колебательного
движения точки ( );
);
iкп
— число степеней свободы колебаний точки
при поступательном движении;
iквр
— число степеней свободы колебаний точки
при вращательном движении.
По аналогии с механическими системами,
каждой молекуле, каждому атому газа
можно приписать определённое число
степеней свободы, рассматривая при этом
их как материальные точки. Так, одноатомная
молекула газа имеет только три степени
свободы поступательного движения (i= 3); двухатомная при упругой связи –
шесть степеней свободы (i= 6), а при жёсткой связи — пять степеней
свободы (i= 5);
трёхатомная молекула при жёсткой связи
между атомами имеет шесть степеней
свободы (i= 6).
Известно,
что средняя кинетическая энергия
поступательного движения молекул равна
Поступательное
движение описывается тремя степенями
свободы, а т.к. все степени свободы
равноправны, то на каждую из них приходится

(12.2)
Но
ни один из видов движения (поступательное,
вращательное, колебательное) не имеет
преимуществ перед другими. Следовательно,
можно утверждать: «На любую степень
свободы приходится в среднем одинаковая
энергия, а молекула, обладающая i степенями
свободы, будет обладать энергией ».
».
Данное утверждение называюттеоремой
о равномерном распределении энергии
по степеням свободы
(теорема Больцмана).
ООО Свой Мастер & PoliStyle
Статьи:
Основные тепловые величины
Температура — мера теплового состояния или степени нагретости тела. Тепловое состояние тела характеризуется скоростью движения его молекул или средней внутренней кинетической энергией тела. Чем выше температура тела, тем больше скорость движения молекул. Температура тела увеличивается или уменьшается в зависимости от того, получает или отдает это тело тепло. Тела, имеющие одинаковую температуру, находятся в тепловом равновесии, т. е. теплообмена между ними нет.
Единицей измерения температуры является градус. Для измерения температуры применяют две шкалы: стоградусную и термодинамическую или абсолютную (Кельвина). Стоградусная шкала имеет две постоянные точки: таяния льда, которая принята за 0 °С, и кипения воды при нормальном атмосферном давлении (760 мм рт. ст.), которая принята за 100 °С. Интервал между этими точками разделен на 100 частей, каждая из которых равна 1 °С. Температуру выше 0 °С обозначают знаком плюс (в тексте обычно не указывают), ниже 0 °С — знаком минус.
Температуру в стоградусной шкале обозначают t, а в абсолютной T. Эти температуры связаны между собой соотношением T= t + 273.
Превращение теплоты в работу и работы в теплоту происходит в одном и том же строго постоянном соотношении, соответствующем тепловому эквиваленту, работы А или механическому эквиваленту тепла Е = 1/A. Значения этих эквивалентов (округленно): А = 1/427 ккал/(кгс·м); E= 427 кгс·м/ккал.
Удельная теплоемкость — количество теплоты, которое нужно сообщить 1 кг или 1 м3 вещества, чтобы повысить его температуру на 1 °С. Для газов и паров различают удельную теплоемкость при постоянном давлении cv н удельную теплоемкость при постоянном объеме су. В зависимости от того, что принимают за единицу вещества, различают теплоемкость: массовую, ккал/(кг·°С); мольную, ккал/(кмоль·°С); объемную, ккал/(м3·°С). Удельную массовую теплоемкость воды, с достаточной для практических расчетов точностью, принимают равной 1 ккал/(кг·°С).
Удельная теплоемкость перегретого водяного пара зависит от температуры и давления, при которых происходит нагрев, а смеси неконденсирующихся газов, кроме того, и от ее состава. При 100 °С объемная удельная теплоемкость составляет, ккал/(м3·°С): водяного пара 0,36; воздуха 0,31; диоксида углерода (углекислого газа) 0,41.
Количество теплоты Q, которое необходимо сообщить телу (например, нагреваемой в котле воде) для повышения его температуры от t1 до t2, равно произведению массы тела m, его удельной теплоемкости c, разности конечной t2 и начальной t1 температуры тела:
Энтальпия — параметр состояния рабочего тела (воды, газа или : пара), характеризующий сумму его внутренней энергии и потенциальной энергии давления (произведения давления на объем). Изменение энтальпии определяется начальным и конечным состоянием рабочего тела.
Температура кипения — температура, при которой вещество переходит из жидкого состояния в парообразное (газообразное) не только с поверхности (как при испарении), а по всему объему.
Удельная скрытая теплота парообразования — теплота, необходимая для превращения 1 кг жидкости, предварительно нагретой до температуры кипения, в сухой насыщенный пар.
Скрытая теплота конденсации — теплота, выделяющаяся при конденсации пара. По значению она равна скрытой теплоте парообразования.
Вступление
Физическое происхождение

Тепловое перемешивание молекул в газе дает представление об их температуре.
Частицы, из которых состоит материя ( молекулы или атомы ), никогда не находятся в состоянии покоя. Они находятся в постоянной вибрации и поэтому обладают определенной кинетической энергией . Температура является косвенным показателем степени микроскопического перемешивания частиц. Кроме того, пространство, пустое от материи, но в котором распространяется свет, также содержит энергию. В хороших условиях с этим излучением может быть связана температура, которая измеряет среднюю энергию составляющих его частиц. Важным примером теплового излучения является излучение черного тела , примером которого являются звезды , излучение которых показывает температуру атомов, находящихся на его поверхности.
Когда два тела соприкасаются, они спонтанно обмениваются тепловой энергией : одно из двух тел имеет частицы с большей кинетической энергией. Приводя их в контакт, удары между частицами вызывают передачу этой микроскопической кинетической энергии от одного тела к другому. Именно этот перенос энергии в физической науке называется теплом .
Для газов кинетическая теория определяет температуру следующим образом:
Тзнак равно13kB∫dv→п(v→)(v→-U→)2{\ displaystyle T = {\ frac {1} {3k_ {B}}} \ int d {\ overrightarrow {v}} \, p ({\ overrightarrow {v}}) \, ({\ overrightarrow {v}} — {\ overrightarrow {U}}) ^ {2}}
- k B — постоянная Больцмана ;
- п(v→,т){\ displaystyle p ({\ overrightarrow {v}}, t)} — вероятностное распределение скоростей,
- v→{\ displaystyle {\ overrightarrow {vb}}} скорость частиц;
- U→{\ displaystyle {\ overrightarrow {U}}} поле скорости (средняя скорость);
- и бесконечно малый объем в окрестностиdv→{\ displaystyle d {\ overrightarrow {vb}}}v→{\ displaystyle {\ overrightarrow {vb}}}
Эти передачи энергии спонтанно приводят к состоянию теплового равновесия, когда два присутствующих тела имеют одинаковую температуру.
Словарь
В области физики и химии принято говорить об обычной температуре для текущей, средней температуры. Например, мы говорим «вода жидкая при комнатной температуре» . Но это наименование не очень формализовано и значение обычной температуры уточняется редко (чаще всего совместно оценивается от 18 до 25 ° C ).
Нормальная температура обычно означает 0 текущего масштаба: это, как правило , ° С .