Этиленгликоль
Содержание:
- Очистка и осушение
- ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
- Что такое этиленгликоль
- История болезни
- Этиленгликоль — Часто задаваемые вопросы
- Этиленгликоль и пропиленгликоль — основные отличия
- Классификация спиртов
- Физико-химические свойства этиленгликоля
- Профессиональная терапия
- Применение
- Первая помощь при развитии отравления
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Параметры эксплуатации этиленгликоля
Этиленгликоль заливают в алюминиевые бочки или в бочки из коррозионно-стойкой стали. По согласованию с потребителем этиленгликоль допускается заливать в стальные неоцинкованные бочки.
Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а так же наливом в ж/д цистернах (по согласованию с потребителем — в специально выделенных ж/д цистернах).
Этиленгликоль хранят в бочках в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках их углеродистой стали.
Родственные материалы этиленгликоля
Весьма близкими к этиленгликолю по свойствам являются диэтиленгликоль, триэтиленгликоль и глицерин, которые так же являются густыми прозрачными жидкостями, легко смешивающимися с водой, спиртом, ацетоном и некоторыми другими растворителями, причем глицерин является безвредным веществом. Диэтиленгликоль широко используется как растворитель смол, масел, нитроцеллюлозы и также в качестве основы антифризов.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали.Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Физико-химические показатели Этиленгликоля (Моноэтиленгликоля, МЭГ)
| # п/п |
Наименование показателя |
Норма | |
| Высший сорт ОКП 24 2212 |
1-й сорт ОКП 24 2212 0130 |
||
| 1 | Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| 2 | Массовая доля диэтиленгликоля, %, не более |
0,05 (0,10) |
1,0 |
| 3 | Цвет в единицах Хазена, не более в обычном состоянии после кипячения с соляной кислотой |
5 20 |
20 Не нормируется |
| 4 | Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| 5 | Массовая доля железа (Fе), %, не более | 0,00001 | 0,0005 |
| 6 | Массовая доля воды, %, не более | 0,1 | 0,5 |
| 7 | Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 (0,001) |
0,005 |
| 8 | Показатель преломления при 20оС | 1,431 — 1,432 | 1,430 — 1,432 |
| 9 | Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 275 350 |
75 |
Не нормируется То же То же |
Температура замерзания водного раствора зависит от массовой доли
следующим образом:
| Массовая доля этиленгликоля (%) в водном растворе | Температура замерзания, ° C |
| 10 | -4 |
| 15 | -5 |
| 20 | -9 |
| 25 | -12 |
| 30 | -14 |
| 40 | -22 |
| 50 | -35 |
| 60 | -49 |
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Екатеринбург 2016
— Понятие об Спиртах
— Применение спиртов в промышленности
Введение
СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Многоатомные спирты
Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Этиленгликоль
Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают путём:
· (I) гидратацией 1,2-дихлорэтана;
· (II) гидратацией хлоргидринов;
· (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
· (IV) окислением этилена перманганатом калия:

ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие с щелочными металлами: образует соли гликоляты

основаниями. Качественным реактивом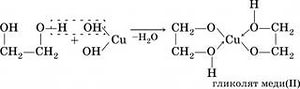
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину)
3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O

4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться
· глиоксалевая и щавелевая кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
Трехатомный спирт,входящий в состав сложных эфиров природного происхождения — жидких и твердых жиров.
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
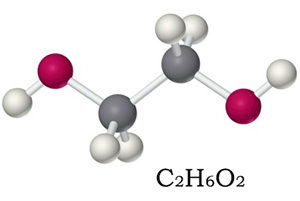
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
История болезни
Сбор анамнеза
У взрослых потребление обычно происходит в суицидальных целях или как альтернатива этанолу. Для составления истории болезни у пациента стоит уточнить наличие симптомов и следующую информацию:
- Количество и временной интервал проглатывания: когда и как долго пациент пил?
- Что употреблял вместе с этиленгликолем? Параллельный прием внутрь этанола снижает токсический эффект.
- Пациент также принимал таблетки или наркотики? Что и сколько?
- Могут ли окружающие люди также ошибочно выпить эту жидкость?
- Есть ли у человека хронические проблемы с алкоголем? Если да, то после лечения отравления ему стоит подобрать эффективный метод кодирования.
Этиленгликоль — Часто задаваемые вопросы
- Можно ли смешивать этиленгликоль с пропиленгликолем?
Ответ на этот вопрос ищет каждый автовладелец, который интересуется, можно ли смешивать охлаждающие жидкости на основе разных гликолей. Не следует этого делать. В случае этиленгликоля и пропиленгликоля основное различие заключается в плотности этих веществ. На практике трудно измерить стойкость жидкости к замерзанию, и это может привести к проблемам в зимнее время года.
- Как отличить этиленгликоль от пропиленгликоля?
Существует метод различения этих двух гликолей, при котором выявляются различия физических свойств, удельной плотности и показателя преломления между этиленгликолем и пропиленгликолем. Показатель преломления является очень полезным параметром для определения того, с каким соединением мы имеем дело. Несколько капель вещества помещают на призму специального прибора, так называемого рефрактометра, и считывают показатель преломления для идентификации.
- Чем этиленгликоль отличается от глицерина?
Оба соединения относятся к одной химической группе, т. е. к спиртам. Они отличаются количеством гидроксильных групп -ОН в молекуле. Глицерин является производным пропана (пропантриола), а этиленгликоль — производным этана (этандиола). В водных растворах они понижают температуру замерзания, а также повышают температуру кипения. При выборе между глицерином и этиленгликолем стоит остановиться на первом, так как он более безопасен в использовании. Более того, он также оказывает меньшее негативное воздействие на окружающую среду.
- Где можно приобрести этиленгликоль?
Этиленгликоль можно купить в химических магазинах или у оптовиков. Цена данного вещества сильно колеблется. Стоит отдать предпочтение продукту наивысшего качества. В ассортимент реагентов Группы PCC также входит этиленгликоль (номер CAS 9005-07-6).
- Какими могут быть симптомы отравления этиленгликолем?
Отравление этиленгликолем очень часто напоминает состояние алкогольного опьянения. Отмечается заметная бессвязность движений, сонливость, учащенное дыхание, повышение артериального давления и, в некоторых случаях, судороги. Нельзя преуменьшать опасность отравления этиленгликолем. Через 24 часа появляются первые симптомы почечной недостаточности. Отравление вызывает нарушение кровообращения и даже глубокое поражение центральной нервной системы.
- Как отличить этиленгликоль от глюкозы?
Различить эти два соединения можно при помощи популярной реакции Троммера. Глюкоза относится к так называемым альдозам, которые, в свою очередь, классифицируются как альдегиды. Известно, что альдегиды поддаются пробе Троммера, в отличие от диолов (например, этиленгликоля), которые не поддаются. Весь эксперимент основан на редукции (испытуемым веществом) синего гидроксида меди (II) CuOH2 до кирпично-красного оксида меди (I) Cu2O в щелочной среде.
Этиленгликоль и пропиленгликоль — основные отличия
Одним из основных различий между этиленгликолем и пропиленгликолем является уровень токсичности. Этиленгликоль токсичен, а пропиленгликоль — нет. При тех применениях, где токсичность не имеет значения, этиленгликоль часто является лучшим выбором в качестве теплоносителя. Этиленгликоль не следует использовать, если есть вероятность его проглатывания или случайного контакта с пищей или питьевой водой. Он также не рекомендуется в системах отопления или охлаждения в таких помещениях, как предприятия пищевой промышленности или другие предприятия, где производятся продукты, предназначенные для потребления. Когда требуется низкая токсичность, предпочтение, как правило, отдается пропиленгликолю — из-за его низкой острой токсичности при пероральном введении.
Оба типа гликолей различаются по своим физическим свойствам. Их химические свойства также различны. Этиленгликоль широко используется там, где важна производительность и нет прямого контакта с людьми или животными. Этиленгликоль обладает отличной теплопроводностью и защитой от замерзания. Низкая вязкость гликоля способствует превосходной эффективности теплообмена, а транспортные свойства превосходят пропиленгликоль при более низких температурах. Однако, поскольку пропиленгликоль имеет более высокую удельную теплоемкость, необходимо циркулировать большее количества этиленгликоля, чем пропиленгликоля для передачи того же количества энергии. Растворы пропиленгликоля имеют более высокую вязкость и температуру застывания, чем этиленгликоль в тех же условиях. При более низких температурах пропиленгликоль, прежде всего, термически менее эффективен, чем этиленгликоль.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
CH3—CH2—OH(C2H5OH).
У многоатомных — несколько групп ОН−.
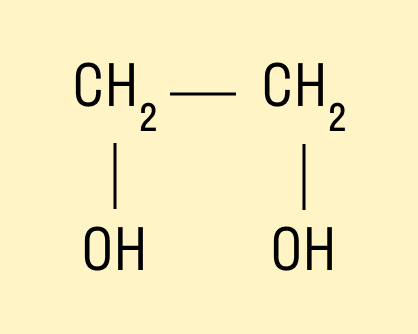
Например, предельный двухатомный спирт этиленгликоль (этандиол):
HO—CH—CH—OH.
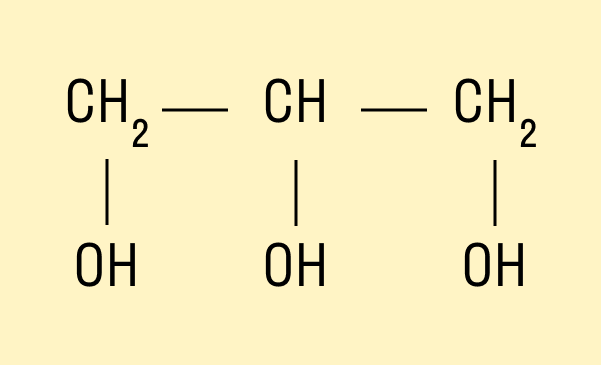
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
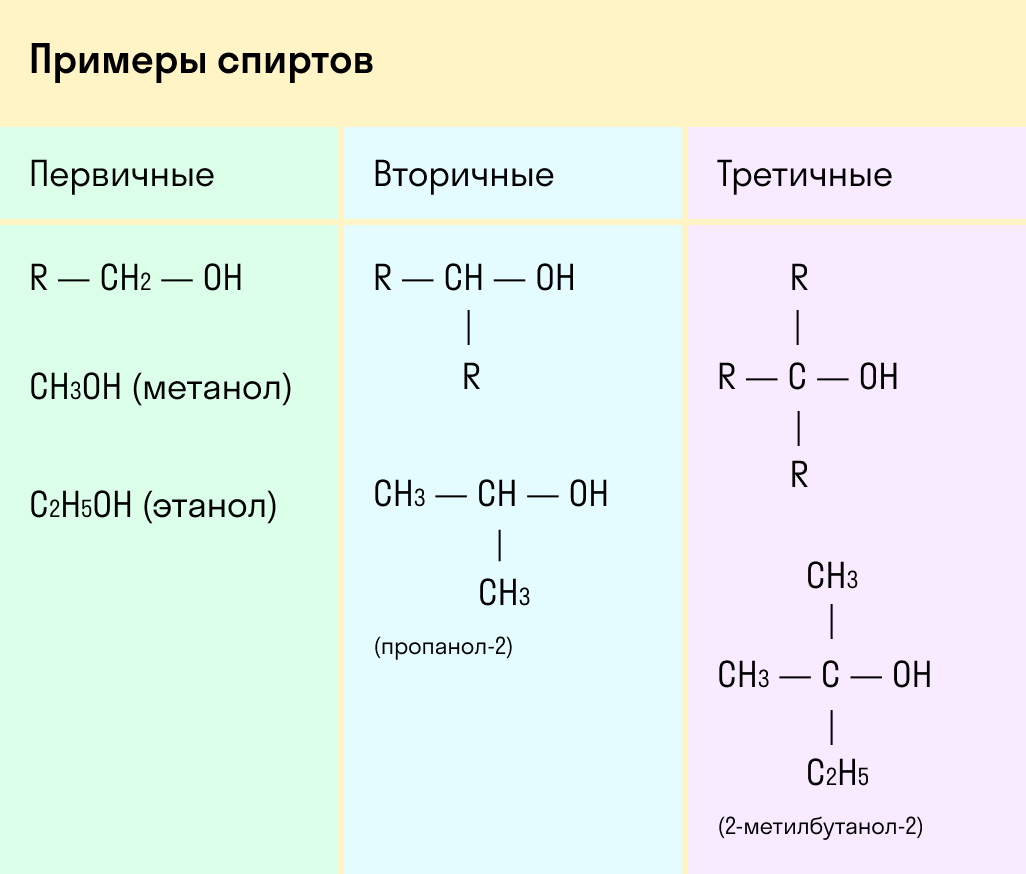
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.
По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
-
Предельные (этанол СН3—СН2—ОН);
-
Непредельные (пропенол СН2=СН—СН2—ОН);
-
Ароматические (фенилметанол С6Н5—СН2ОН).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получить

Физико-химические свойства этиленгликоля
Этиленгликоль с формулой CH2OH2, также известный как 1,2-этандиол, является популярным органическим соединением. Паспорт безопасности этиленгликоля, а также других веществ является основным источником информации об их физических и химических свойствах. Этиленгликоль — основной компонент антифризов в ОВиК и автомобильных системах. Формула гликоля четко указывает на его принадлежность к химической группе дигидроксиспиртов, также известных как диолы. Таким образом, гликоль в виде спирта представляет собой бесцветную жидкость с высокой вязкостью и сладким вкусом. Помимо отличной смешиваемости с водой, он также хорошо растворяется в альдегидах, кетонах и уксусной кислоте, но совсем не растворяется в четыреххлористом углероде. Относительно дешевый в производстве. К его недостаткам можно отнести кристаллизацию при низких температурах и более низкую (по сравнению с пропиленгликолем) теплоемкость (около 50% от теплоемкости воды).
Этиленгликоль имеет высокую температуру кипения (197°C) при низкой молекулярной массе. Это связано с сильной ассоциацией молекул в жидкой фазе, вызванной образованием водородных связей. В чистом виде этиленгликоль замерзает примерно при температуре -13°С, но смесь этиленгликоль: вода может оставаться жидкой при гораздо более низких температурах. Например, смесь 40% воды и 60% гликоля может выдерживать температуры до -37°C. Следует отметить, что этиленгликоль смешивается с водой в неограниченной пропорции. Это связано с наличием в структуре двух гидроксильных групп.
Изучая справочные материалы или предложения производителей, вы можете встретить термин моноэтиленгликоль, сокращенно МЭГ. Однако стоит иметь в виду, что моноэтиленгликоль и этиленгликоль — это одно и то же вещество.
Профессиональная терапия
В алгоритм оказания неотложной помощи входит обязательный вызов бригады медиков, даже если интоксикация этиленгликолем кажется совсем легкой. Врачи при отравлении пациента ядовитым веществом применят следующие терапевтические методы:
- обеспечат пострадавшему покой и хороший доступ кислорода,
- назначат АТФ и витамины из группы B, а также витамин C,
- для снижения воспалительной реакции может быть введен Преднизолон,
- пострадавшему назначают фолиевую кислоту в больших количествах, чтобы связать продукты распада этиленгликоля,
- для коррекции метаболизма и водно-солевого баланса используют солевые растворы.
Для эффективной борьбы с отравлением обязательно вводится антидот.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике:
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в |системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА
1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- компонент в составе систем жидкостного охлаждения компьютеров
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
Первая помощь при развитии отравления
При появлении первых признаков острого этиленгликолевого отравления нужно немедленно обращаться за медицинской помощью. Времени на самостоятельный поиск больницы или обращение в поликлинику нет, поэтому следует вызывать бригаду скорой медицинской помощи. Если отравившийся буйный и агрессивный, следует также вызвать наряд полиции.
В случае интоксикации этиленгликолевыми испарениями нужно вывести пострадавшего на свежий воздух и дать ему попить теплого сладкого чая или воды. Также можно умыть его водой, успокоить.
При пероральном отравлении этиленгликолем первая доврачебная помощь может быть оказана людьми, оказавшимися рядом с пострадавшим. В случае тяжелого отравления от нее зависит жизнь больного.
Ниже рассмотрены действия, которыми вы можете самостоятельно помочь отравившемуся человеку во время ожидания СМП.
Промывание желудка
Эта процедура является главным компонентом первой помощи при этиленгликолевой пероральной интоксикации. Ее следует провести сразу же при появлении малейших признаков отравления.
Для того чтобы очистить желудочную полость, больному нужно выпить залпом большое количество простой воды нейтральной температуры (около 1 литра) и вызвать рвоту. Это можно сделать народным методом – надавив пальцем на корень языка.
Очищение желудочной полости лучше всего повторить несколько раз. Таким образом будет достигнуто максимально эффективное очищение желудка.
Процедура по промыванию желудка имеет ряд противопоказаний, перечисленных далее:
- Неадекватное состояние больного, пребывающего в алкогольном опьянении. Если вы понимаете, что отравившийся человек не адекватно себя ведет, не может выполнять команды, не давайте ему ничего пить. При поражении этиленгликолем нарушается глотательный рефлекс и больной может захлебнуться водой или рвотными массами.
- Нарушенное сознание больного. Это может быть сопор или кома. Больным в таком состоянии проводят очищение желудка медики СМП, используя желудочный зонд.
- Появление темной или кровавой рвоты. Такой тревожный симптом может означать развитие кровотечения из поврежденных сосудов пищевода, желудка или двенадцатиперстной кишки.
- Отказ отравившегося от процедуры. Люди в терминальных стадиях алкоголизма частично теряют умственные способности. И не могут адекватно оценить тяжесть своего состояния.
Сорбенты
Сорбенты – это препараты, которые должны быть всегда под рукой. После промывания желудка дайте больному выпить любой препарат из этой лекарственной группы, например:
- активированный уголь;
- атоксил;
- энтеросгель;
- белый уголь;
- смекта;
- полисорб.
Дозировка препарата рассчитывается согласно инструкции.